
题目列表(包括答案和解析)
| ||
| ||

| ||
| ||
X、Y、Z、W均为短周期元素,且原子序数依次递增,现有A、B、C、D、E五种物质均含元素W,有的还可能含有元素X、Y、Z。
①X、Z是同族元素,Y与W也是同族元素,X的电子层数与核外电子总数相同。
②常温常压时,B、C为气体,B、C混合时有淡黄色固体A析出。
③元素W在D中呈现最高正价,D的稀溶液与盐E的溶液反应时,产物中有B生成。
④用氯水漂白的布,为了除去多余的氯气,可在碱性条件下(如氢氧化钠溶液),加入盐E,其产物中有一种含元素W的物质,W在该物质中呈现最高正价。
(1)物质C的电子式是 ;
(2)写出②中反应的化学方程式 ;
(3)写出④中反应的离子方程式
| ||
(1)实验室用二氧化锰和浓盐酸制取氯气时,有以下五步主要操作。请你排列出正确而简捷的程序,将序号(用a、b、c……表示)填入括号内:
( )将烧瓶固定在铁架台上
( )把酒精灯放在铁架台上,根据酒精灯确定铁圈位置,放好石棉网
( )用药匙向烧瓶中加入二氧化锰,向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中
( )检查装置的气密性
( )在烧瓶上装好分液漏斗,连接好导气管
(2)多余的氯气用足量的NaOH溶液吸收,而不用饱和的澄清石灰水吸收,其原因是_________________________________________________________。
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)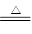 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
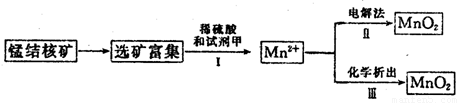
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com