
题目列表(包括答案和解析)
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
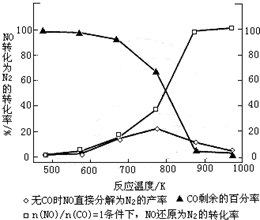
| n(NO) |
| n(CO) |
(8分)氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被——NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是 ;N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1 038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为 ,它的沸点比PH3的沸点 ,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)____ ____(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ______,Y的第一电离能比X的______ __(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是___________ ___________________。
N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH=-534 kJ·mol-1
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g) ====3N2(g)+4H2O(l);ΔH=-1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g) ====3N2(g)+4H2O(g);ΔH=-1 000.3 kJ·mol-1
C.N2H4(g)+NO2(g) ====3/2N2(g)+2H2O(l);ΔH=-1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g) ====3N2(g)+4H2O(g);ΔH=-1 135.7 kJ·mol-1
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比H2O(g)_________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是_______,Y的第一电离能比X的_______(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_____________。
(4)已知下列数据:
Fe(s)+![]() O2(g)====FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)====FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+![]() O2(g)====X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)====X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com