
题目列表(包括答案和解析)
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

① 甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
(20分)Ⅰ.已知:R-CH=CH-O-R′(烃基烯基醚)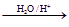 R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下: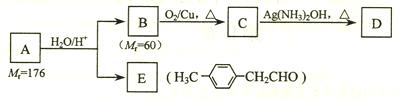
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是___________________;A的结构简式为________________________。
⑶写出C → D反应的化学方程式:_______________________________________。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:
_________________________、________________________。
①属于芳香醛;②苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔(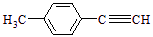 )的一条路线如下:
)的一条路线如下: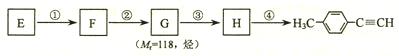
⑸写出G的结构简式:____________________________________。
⑹写出反应所加试剂、反应条件:反应② 反应③
(7)写出反应类型:反应① ;反应④
(共20分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ___,完全燃烧时消耗O2的量最多的是__ _,
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备:
②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠溶液共热
⑧由甲苯制取TNT ⑨往苯酚钠溶液中通入CO2溶液中
(1)其中属于取代反应的是 ;属于氧化反应的是 ;
属加成反应的是 属于聚合反应的是
(2)写出⑦、⑧、⑨的化学方程式
⑦
⑧
⑨
(20分)
20-Ⅰ(6分)固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可
减少二氧化硫对大气的污染。下列物质中可用做固硫剂的有
A.CaO B.Na2C03 C.NH4N03 D. P205
20-Ⅱ(14分)以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
请回答下列问题:
(1)在炉气制造中,生成S02的化学方程式为______________________________;
(2)炉气精制的作用是将含S02的炉气_______________、_______________及干燥,如果炉气不经过精制,对S02催化氧化的影响是 ____________________________ :
(3)精制炉气(含SO2体积分数为7%、O2为ll%、N2为82%)中S02平衡转化率与温度及压强关系如下图所示。在实际生产中,S02催化氧化反应的条件选择常压、450℃;左右(对应图中A点),而没有选择S02转化率更高的B或C点对应的反应条件,其原因分别是______________________________、______________________________;
(4)在S02催化氧化设备中设置热交换器的目的是_______________、_______________,从而充分利用能源。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com