
题目列表(包括答案和解析)
 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.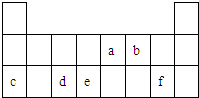 (2011?深圳一模)图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )
(2011?深圳一模)图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )
| 实验操作 | 预期的现象及结论 |
| 步骤1:取1mL0.1mol/L Na2SO3和1mL0.1mol/L KI溶液于试管中,混合后滴入2~3滴新制氯水,振荡. | |
| 步骤2: 向试管中加入足量的1mol?L-1HCl后再滴入 数滴(少许)1mol?L-1BaCl2,振荡试管. 或向试管中滴入少量淀粉溶液,振荡试管 向试管中加入足量的1mol?L-1HCl后再滴入 数滴(少许)1mol?L-1BaCl2,振荡试管. 或向试管中滴入少量淀粉溶液,振荡试管 |
若有白色沉淀产生,则说明还原性:SO32->I-, 若没有白色沉淀产生,则说明还原性:I->SO32-. 或若不变蓝色,说明还原性:SO32->I-, 若变蓝色,说明还原性:I->SO32-. 若有白色沉淀产生,则说明还原性:SO32->I-, 若没有白色沉淀产生,则说明还原性:I->SO32-. 或若不变蓝色,说明还原性:SO32->I-, 若变蓝色,说明还原性:I->SO32-. |
| 步骤3:取1mL0.1mol/L KI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡. | |
步骤4: 向试管中滴入少量淀粉溶液,振荡试管. 或向试管中滴入少量10%KSCN溶液,振荡试管. 向试管中滴入少量淀粉溶液,振荡试管. 或向试管中滴入少量10%KSCN溶液,振荡试管. |
若不变蓝色,说明还原性:Fe2+>I-, 若变蓝色,说明还原性:I->Fe2+.或若不变红色,说明还原性:I->Fe2+, 若变红色,说明还原性:Fe2+>I-. 若不变蓝色,说明还原性:Fe2+>I-, 若变蓝色,说明还原性:I->Fe2+.或若不变红色,说明还原性:I->Fe2+, 若变红色,说明还原性:Fe2+>I-. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com