
题目列表(包括答案和解析)
A(6分)生活中常用药品很多,如:①碘酒、②麻黄碱、③青霉素、④阿司匹林、⑤葡萄糖注射液、⑥胃舒平(含氢氧化铝、淀粉等)。
⑴上述物质中属于抗生素的是____ _(填写序号,下同),不属于人工合成药物的是 。
⑵胃舒平可防治胃酸分泌过多,其发挥功效时的离子方程式
为 。
⑶药品生产常选用淀粉作填充剂、粘合剂。服用添加淀粉的药物不会伤害身体的原因是_______________________________________________________________。
⑷低血糖病症发作时,喝葡萄糖水可快速见效。葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是_________(填写字母,下同)。
A.加成反应 B.取代反应 C.氧化反应 D.聚合反应
⑸下列关于药物使用的说法中,正确的是__________。
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病都可以到药店自己买药服用医治,不用到医院就诊
四、本大题3题,共21分。
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
本题含两小题,共14分。
(1)(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
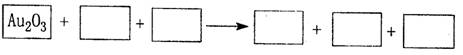
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)(6分)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
本题含两小题,共14分。
(1)(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)(6分)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
本题共有2小题,共15分,①(9分)命名下列有机物

②(6分)有人曾提出苯除了有平面正六边形结构外,还可能有空间立体结构,例如下面的Ⅰ式和Ⅱ式:
Ⅰ式: Ⅱ式:
Ⅱ式: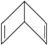
(1)若以Ⅰ式为主体,其一元取代物分子中2,4,6位上的氢原子性质相同,3,5位上的氢原子性质相同。则2,4,6-三氯硝基苯的结构简式为_____________。
(2)若Ⅱ式分子生成二氯苯,其可能有的同分异构体有6种,则其四氯苯的同分异构体有_______种。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com