
题目列表(包括答案和解析)
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g)CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
我们跟踪测定H2O的物质的量浓度,
如图所示:
则0~20min的反应速率是 从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
我们跟踪测定H2O的物质的量浓度,
如图所示:
则0~20min的反应速率是 从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
我们跟踪测定H2O的物质的量浓度,
如图所示:

则0~20min的反应速率是 从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
 CO2(g)+H2(g)
CO2(g)+H2(g)
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)

 到
到 的合成路线(用合成路线流程图表示,并注明反应条件)。提示:
的合成路线(用合成路线流程图表示,并注明反应条件)。提示: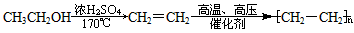
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com