
题目列表(包括答案和解析)
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol?L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A、升高温度该反应的平衡常数K减小 |
| B、20~40s 内,v(N2O4)=0.004mol?L-1?s1 |
| C、反应达平衡时,吸收的热量为0.30Q kJ |
| D、100s时再通入0.40mol N2O4,达新平衡时N2O4的转化率增大 |
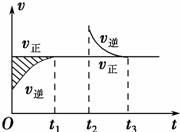 某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A、Z和W在该条件下至少有一个是为气态 | B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 | C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | D、若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
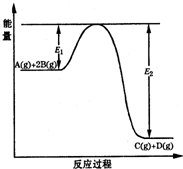 某可逆反应的反应过程中能量变化如图所示,回答下列问题.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.| c(C)c(D) |
| c(A)c2(B) |
| c(C)c(D) |
| c(A)c2(B) |
| 容器编号 | 起始浓度mol/L | 平衡时的浓度mol/L | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A、平衡时,乙中颜色更深,a>0.008 | ||
B、平衡时,放出的热量:Q1=
| ||
| C、该温度下,该反应的平衡常数K=4 | ||
| D、平衡后,向甲中再充入0.004mol HI气体,再次达到平衡时HI的百分含量不变 |
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com