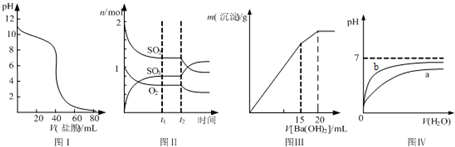
下表为长式周期表的一部分,其中的编号代表对应的元素.
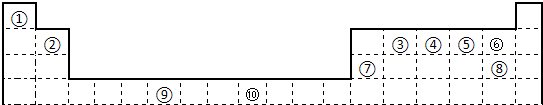
试填空.
(1)写出上表中元素⑨原子的外围电子排布式
3d54s1
3d54s1
.
(2)元素③与⑧形成的化合物中元素③的杂化方式为:
sp3
sp3
杂化,其形成的化合物的晶体类型是:
分子晶体
分子晶体
.
(3)元素④、⑤的第一电离能大小顺序是:
N
N
>
O
O
(用元素符号表示);元素④与元素①形成的X分子的空间构型为:
三角锥形
三角锥形
.请写出与N
3-互为等电子体的分子、离子的化学式
CO2
CO2
,
CNO-
CNO-
(各写一种).
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
HF分子之间有氢键,能形成缔合分子(HF)n
HF分子之间有氢键,能形成缔合分子(HF)n
.
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式
Na2BeO2
Na2BeO2
.
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为
2:3
2:3
.


 (2012?福建)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
(2012?福建)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )