
题目列表(包括答案和解析)
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
研究NO2、SO2、CO等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为______。
利用反应6NO2+8NH3  7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+ O2
(g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g) △H =______kJ·mol-1
SO3 (g) +NO(g) △H =______kJ·mol-1
一定条件下,将体积比为1:2的 NO2和 SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)  CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。

研究NO2、SO2、CO等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为______。
利用反应6NO2+8NH3 7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+ O2(g)2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) SO3 (g) +NO(g) △H =______kJ·mol-1
一定条件下,将体积比为1:2的 NO2和 SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应6NO2+8NH3
 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______________L。
(2)已知:2SO2(g)+ O2 (g)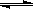 2SO3
(g) △H =-196.6kJ·mol-1
2SO3
(g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 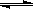 2NO2
(g) △H =-113.0kJ·mol-1
2NO2
(g) △H =-113.0kJ·mol-1
则反应NO2(g)+
SO2 (g) 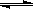 SO3
(g) +NO(g)的△H =______kJ·mol-1
SO3
(g) +NO(g)的△H =______kJ·mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2
(g) 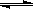 CH3OH
(g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
CH3OH
(g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________________________。
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________________升。
 7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L.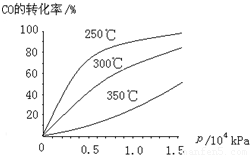
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com