
题目列表(包括答案和解析)
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ΔH=-802.3kJ/mol
该热化学反应方程式的意义是_____________________________________。
(2)已知2g乙醇完全燃烧生成液态水放出Q kJ的热量,写出表示乙醇燃烧热的热化学方
程式:____________________________________________________________.
(3)已知拆开1mol H-H键,1mol N-H键,1mol 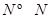 键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599kJ/mol ③
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1mol C2H2(g)反应的焓变:
____________________________.
[s1] 已知25℃、101kpa时,一些物质的燃烧热为:
|
化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
|
△H/(kJ/mol)
|
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1∶1 B.1∶3 C.1∶4 D.2∶3
[s1]22.
[s1] 已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol)
| -283.0 | -285.8 | -726.5 | -890.3 |
请回答下列问题。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵根据盖斯定律完成下列反应的热化学方程式:
CO(g)+ 2H2(g)= CH3OH(l);△H= 。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
A.1∶1 B.1∶3 C.1∶4 D.2∶3
[s1]22.
A、
| ||||
| B、B2H6 (g)+3O2 (g)?B2O3(s)+3H2O (g)△H=-2165 kJ?mol-1 | ||||
| C、B2H6 (g)+3O2 (g)?B2O3(s)+3H2O (g)△H=-2033 kJ?mol-1 | ||||
| D、B2H6 (g)+3O2 (g)?B2O3(s)+3H2O(l)△H=-2165 kJ?mol-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com