
题目列表(包括答案和解析)
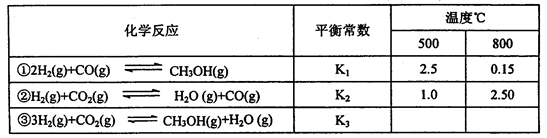
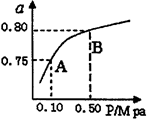
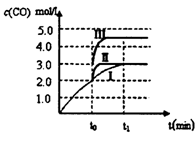
| 1 | 2 |
被誉为改变未来世界的十大科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业.它是一种不经过燃烧,将燃料的化学能直接转换成电能的装置.这主要由燃料、氧化剂、电极、电解质组成.在结构上与传统电池一样具有正负电极,正负电极被电解质分隔.它以还原剂(用氢作燃料,也可以添加一个氢气变换器,直接使用甲醇、天然气、甚至石油、柴油、煤等作燃料)为负极反应物,以氧化剂(如氧气、空气等)为正极反应物.为了使燃料便于进行电极反应.要求电极材料兼有催化剂的特性.可用多孔碳多孔镍、铂、钯等贵金属以及聚四氟乙烯等电极材料.电解质则有碱性、酸性、熔融盐和固体电解质及高聚物质子交换膜等数种.
如下图所示是一种氢——氧燃料电池的工作原理图,其电解质为有机高分子聚合物:
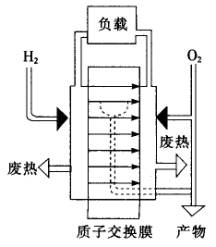
(1)燃料电池中质子交换膜的作用是________________________.
(2)写出氢氧燃料电池正负极发生的电极反应式(注明是氧化反应还是还原反应)和电池的总反应方程式___________________________.
(3)若用燃料电池发电,输出电流的电流强度为533 A,则每小时能合成多少水?
(4)电池燃料氢可利用甲醇、天然气、石油、柴油等,通过一个氢气变换器而得到.写出利用天然气转化为氢气的化学方程式___________________.
(5)请根据文中质子交换膜燃料电池工作原理图,说明负载的电流方向为__________________.
(6)用某种燃料电池给电炉供电,设电炉的额定功率P0=400 W,电池在不接负载时的路端电压与电炉的额定电压相同,当电炉接到该电源上时,电炉实际消耗的功率P1=324W.若两个这样的炉并联接到该电源上,求两个电炉实际消耗的总功率P2为多少?
如下图所示是一种氢——氧燃料电池的工作原理图,其电解质为有机高分子聚合物:
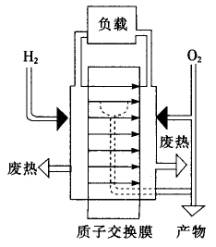
(1)燃料电池中质子交换膜的作用是________________________.
(2)写出氢氧燃料电池正负极发生的电极反应式(注明是氧化反应还是还原反应)和电池的总反应方程式___________________________.
(3)若用燃料电池发电,输出电流的电流强度为533 A,则每小时能合成多少水?
(4)电池燃料氢可利用甲醇、天然气、石油、柴油等,通过一个氢气变换器而得到.写出利用天然气转化为氢气的化学方程式___________________.
(5)请根据文中质子交换膜燃料电池工作原理图,说明负载的电流方向为__________________.
(6)用某种燃料电池给电炉供电,设电炉的额定功率P0=400 W,电池在不接负载时的路端电压与电炉的额定电压相同,当电炉接到该电源上时,电炉实际消耗的功率P1=324W.若两个这样的炉并联接到该电源上,求两个电炉实际消耗的总功率P2为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com