
题目列表(包括答案和解析)
氧化还原反应在生产和生活中使用非常广泛。
I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. Cl2 B. O2 C. FeCl3 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
![]() (1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
![]() (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
![]() (3)根据上述反应可推知 。
(3)根据上述反应可推知 。
![]() a.氧化性:
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
![]() c.还原性:
c.还原性:![]() d.还原性:
d.还原性:![]()
![]() (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方![]() 向和数目:
向和数目: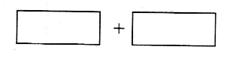
| ① |
| ② |
| Mg800℃ |
| ||
| ||
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 ,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
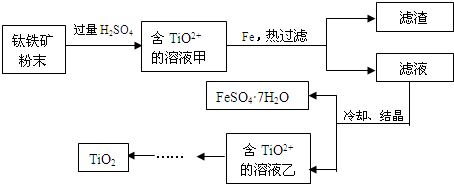
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
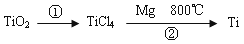
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: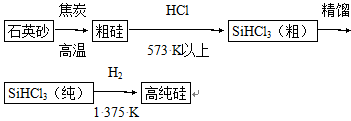
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式____________________;H2还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)_________________________ ____。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
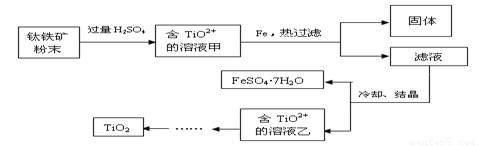
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: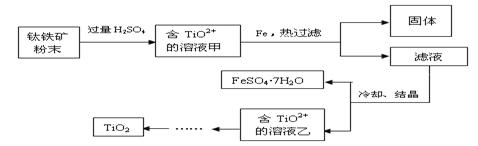
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com