
题目列表(包括答案和解析)
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
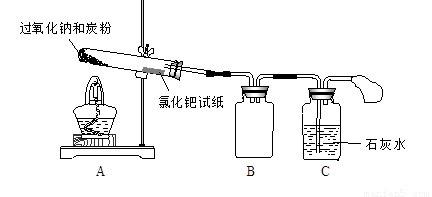
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
 II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是 。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是 。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为
(填化学式), ①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为
(填化学式), ①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。

 II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的 Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论: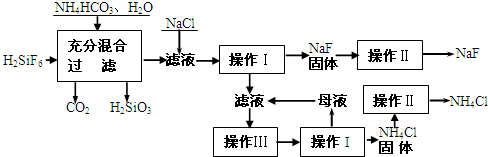
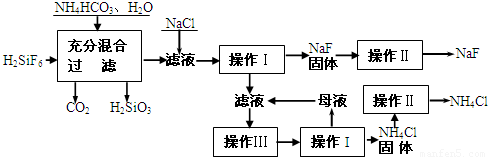
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
| NH4Cl溶解度 | 33.3g | 37.2g | 41.4g |
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
| NH4Cl溶解度 | 33.3g | 37.2g | 41.4g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com