
题目列表(包括答案和解析)
(共10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(共10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。依照该规律,请判断下列反应不能成立的是______(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa→NaHCO3+C6H5OH D.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值约为_______(填数值)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液;②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
请根据上述反应,总结出复分解反应发生的另一规律 。根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式 。
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C.CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a 12.5 mL(填“大于”、“小于”或“等于”)
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示 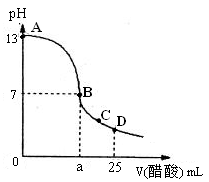
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a 12.5 mL(填“大于”、“小于”或“等于”)
(共10分)
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
①图中所示反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”、“不需要”或“不一定”)加热,该反应的△H = (用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________________________________。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ ①C(s)+O2(g) === CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:②C(s)+H2O(g) === CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
③2CO(g)+O2(g) === 2CO2(g) ΔH3<0 ④2H2(g)+O2(g) === 2H2O(g) ΔH4<0
请回答下列问题:
①判断两种途径放热:途径Ⅰ放出的热量________途径Ⅱ放出的热量(填“大于”、“等于”或“小于”)。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_________________________________。
③由于制取水煤气的反应里,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________能量才能转化为生成物,因此其反应条件为________。
(3)已知:Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g) === 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com