
题目列表(包括答案和解析)
(3分)基态原子的核外电子排布可以用“原子实+价电子”的形式表示。例如,80Hg的核外电子排布可表示为:[Xe]4f145d106s2,请排出第164号元素基态原子的价电子构型 ① ;它属于第 ② 周期,第 ③ 族。
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
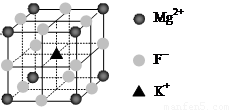
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。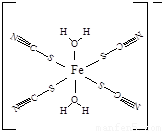


硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com