(14分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO
4和(NH
4)
2SO
4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO
4?7H
2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
(已知: (NH
4)
2SO
4+FeSO
4+ 6H
2O

(NH
4)
2SO
4?FeSO
4?6H
2O↓)根据下图回答:

(1)步骤1中Na
2CO
3的主要作用是
。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):
。步骤2中溶液趁热过滤的原因是
。
(3)步骤3中,加入(NH
4)
2SO
4固体后,应加热到溶液表面出现晶膜时,停止加热。为什么不能蒸干?
。需经过的实验操作包括:
、
、减压过滤(或抽滤)等得到较为干燥
的晶体。步骤3中制得的晶体要用无水乙醇洗涤的目的是
。
(4)摩尔盐产品中离子的检验:
甲同学提出可以用湿润的
试纸、稀盐酸和
溶液检验出这三种离子。
乙同学提出检验产品中的Fe
2+,可以用KSCN溶液和另一种试剂
来检验,试简述乙同学操作和现象:
。
(5)产品中Fe
2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe
3+。为了测定摩尔盐产品中Fe
2+的含量,一般采用在酸性下用KMnO
4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO
4溶液滴定,当溶液中Fe
2+全部被氧化时,消耗KMnO
4溶液体积10.00 mL。
①本实验的指示剂
。
②KMnO
4溶液置于
(酸式、碱式)滴定管中
③产品中Fe
2+的质量分数为
。


 (NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
(NH4)2SO4?FeSO4?6H2O↓)根据下图回答:
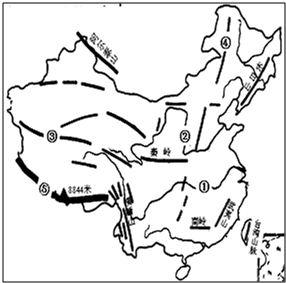 读“中国地形图”,回答下列问题:
读“中国地形图”,回答下列问题: