
题目列表(包括答案和解析)
水的电离过程为H2O OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7 mol/L,则此时的C(OH-)也为2×10-7 mol/L
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少?(设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。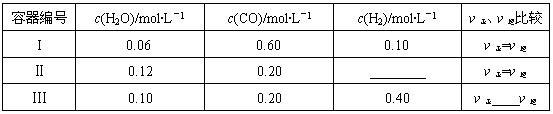
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
,该溶液中的离子浓度由大到小的顺序是: 。
(3)有浓度均为0.1 mol?L-1的 ①盐酸②硫酸③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式: ,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)= mol/L(忽略溶液体积的变化)。
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
难点磁场
提示:根据电荷守恒,可知A错B对。根据由水电离产生的H+和OH-个数相等,可知C对。根据Na2S中,Na+个数是S2-的两倍,可知D对。
答案:BCD
歼灭难点训练
1.提示:常温下,c(H+)=1.0×10-7 mol?L-1,即每升水中已电离的水的物质的量是1.0×10-7 mol,而每升水的物质的量是――水的电离.files/image045.gif) ,则:
,则:
n=――水的电离.files/image047.gif) mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
答案:B
2.提示:本题有两种解法。
方法1(常规解法):NaOH(aq)中:
c水(OH-)=c水(H+)=――水的电离.files/image049.gif) mol?L-1=1.0×10-5 mol?L-1
mol?L-1=1.0×10-5 mol?L-1
CH3COONa(aq)中:
c′水(OH-)=c′总(OH-)=10-9 mol?L-1
则A∶B=10-4
方法2(巧解法):NaOH(aq)中,水的电离被抑制;CH3COONa(aq)中,水的电离被促进;故A<B。
答案:B
3.提示:c水(H+)=1.0×10-13 mol?L-1,则该溶液可能是强碱性溶液,也可能是强酸性溶液,总之,水的电离被抑制。因而“一定不可能大量存在”是指酸性和碱性条件下都不能大量存在。
答案:BC
评注:若去掉题干中的“不可”,则选D。若去掉题干中的“一定不”,则选AD。
4.提示:Na3PO4完全电离,水部分电离:
――水的电离.files/image007.jpg) Na3PO4====3Na++PO
Na3PO4====3Na++PO――水的电离.files/image043.gif)
H2O――水的电离.files/image052.jpg) H++OH-
H++OH-
PO――水的电离.files/image043.gif) 发生系列水解:
发生系列水解:
PO――水的电离.files/image043.gif) +H2O
+H2O――水的电离.files/image054.jpg) HPO
HPO――水的电离.files/image039.gif) +OH-
+OH-
HPO――水的电离.files/image039.gif) +H2O
+H2O――水的电离.files/image054.jpg) H2PO
H2PO――水的电离.files/image058.gif) +OH-
+OH-
H2PO――水的电离.files/image058.gif) +H2O
+H2O――水的电离.files/image054.jpg) H3PO4+OH-
H3PO4+OH-
答案:8
(1)c(Na+)+c(H+)==c(OH-)+――水的电离.files/image043.gif) )+
)+――水的电离.files/image039.gif) )+c(H2PO
)+c(H2PO――水的电离.files/image058.gif) )
)
(2)c(H+)+c(HPO――水的电离.files/image039.gif) )+
)+――水的电离.files/image058.gif) )+
)+
(3)c(Na+)==――水的电离.files/image043.gif) )+
)+――水的电离.files/image039.gif) )+
)+――水的电离.files/image058.gif) )+
)+
w.w.w.k.s.5.u.c.o.m
――水的电离.files/image002.gif) www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com