
题目列表(包括答案和解析)
| ||
| 高温高压 |
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
(12分)(1)(4分)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①![]() 白磷
白磷![]()
![]()
②![]() 红磷
红磷![]()
![]()
写出白磷转化为红磷的热化学方程式:__________________________。则对应下
列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_____________。


(2)(8分)有右图装置:回答下列问题:
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上
的电极反应方程式为:__________________。
③锌与铁组成的合金在潮湿的空气中,
锌被腐蚀而另一种金属被保护,这种保护方法叫
做_______,正极反应式为__________________ 。
![]() ④装置B中是浓度均为
④装置B中是浓度均为![]() 的NaCl、CuSO
的NaCl、CuSO![]() 混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C
混合溶液,溶液体积为500mL。当装置A中Zn棒质量减少32.5g时,C![]() 上质量增加____________g;
上质量增加____________g;
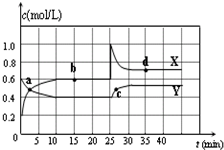 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是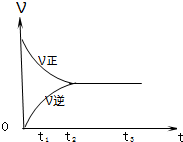
 2SO3 的两个素材:
2SO3 的两个素材: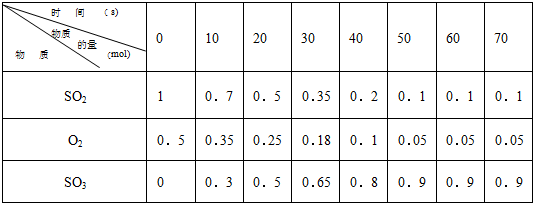
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2 → 2 (1-x) Fe2O3 + 4 SO2
(1)含FeS2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com