
题目列表(包括答案和解析)
全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B. 金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M一ne一——Mn+
D.这种方法称为牺牲阳极的阴极保护法
某课外活动小组同学用下图装置进行实验,试回答下列问题:
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为 
②对于上述实验,下列说法正确的是 (填序号)。
| A.溶液中Na+向B极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA |
某课外活动小组同学用下图装置进行实验,试回答下列问题:
 |
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为
②对于上述实验,下列说法正确的是 (填序号)。
A. 溶液中Na+向B极移动
B. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D. 若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因 。
某课外活动小组同学用下图装置进行实验,试回答下列问题:
 |
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为
②对于上述实验,下列说法正确的是 (填序号)。
A. 溶液中Na+向B极移动
B. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D. 若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因 。
某课外活动小组同学用下图装置进行实验,试回答下列问题:
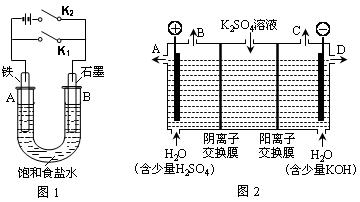
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为 ![]()
②对于上述实验,下列说法正确的是 (填序号)。
A. 溶液中Na+向B极移动
B. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D. 若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com