
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T
2温度时达到平衡后向容器加压的变化情况,回答下列问题:
(1)温度T
1>
>
T
2(填“>”“=”或“<”).
(2)正反应是
放热
放热
反应(填“吸热”或“放热”).
(3)如果A、B、C均为气体,则m
>
>
2(填“>”“=”或“<”).
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强
增大
增大
(填“增大”“减小”或“不变”),平衡
不
不
移动(填“向正反应方向”“向逆反应方向”或“不”).
(5)已知2A(g)+B(g)?2C(g)△H=-a kJ?mol
-1(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为ω mol/L,放出热量b kJ.
①a
>
>
b(填“>”“=”或“<”).
②若将反应温度升高到700℃,该反应的平衡常数将
减小
减小
(填“增大”“减小”或“不变”).
③在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
(说出一种即可)

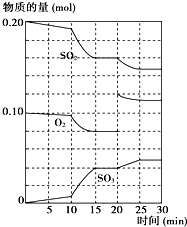 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题: