
题目列表(包括答案和解析)
金属镍,铁及非金属元素碳在合金材料,有机合成材料中有广泛的应用. 请回答下列问题:
(1)Ni原子的核外电子排布式为 .
(2)Fe原子的外围电子排布图为 .
(3)含碳化合物丙烯腈(H2C=CH—C≡N)分子中碳原子轨道杂化类型为
(4)NiO,FeO的晶体类型均与氯化钠晶体相同,Ni2+和Fe2+离子半径分别为69 Pm和78 Pm,则两种物质的熔点
NiO FeO(填“>”或“<”),判断依据是 .
(5)CaC2晶体的晶胞也与氯化钠相似,但由于CaC2晶体中的C22-存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C22-周围距离最近且相等的Ca2+数目为 ,C22-与O22+互为等电子体,写出O22+的电子式 .
(6)铁在一定条件下可形成体心立方堆积的晶体,设铁原子半径为r,请用含r的代数式表示该晶体空间利用率 .
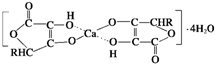
金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要.
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于________变化.钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择________(选填“铜块”、“锌块”、“铅块”).
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:
请回答下列问题:
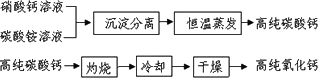
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为________.
②实验室常采用________操作进行沉淀分离.
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是________.
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止________(用化学方程式表示).
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少________污染.20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用________方法区分尼龙和蚕丝.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com