
题目列表(包括答案和解析)
 [化学--物质结构与性质]
[化学--物质结构与性质]| 化学键 | C-O | C═O | C≡O |
| 键能(kJ/mol) | 351 | 803 | 1071 |
| 化学能 | N-N | N═N | N≡N |
| 键能(kj/mol) | 159 | 418 | 945 |
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的 键比 键稳定(填“![]() ”或“
”或“![]() ”)。
”)。
(3)(CH3)3NH+和![]() 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)。
a. 助燃剂
b.“绿色”溶剂
c. 复合材料
d. 绝热材料
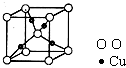
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com