14、钛(Ti是一种重要的航天金属材料.某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究.过程如下:
【提出假设】a.Ti金属活动性比Al强. b.Al金属活动性比Cu强.
【查阅资料】钛能与盐酸反应.
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象.
【操作分析】三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是
A
.
A.除去氧化膜,利于直接反应 B.使表面光亮,易观察现象 C.使反应金属温度相同,易反应
【实验现象】
| 金 属 |
Ti |
Al |
Cu |
| 与盐酸反应现象 |
反应缓慢 |
反应剧烈 |
无明显现象 |
【实验结论】(1)原假设中
a
不正确(填“a”、“b”或“ab”).
(2)三种金属的金属活动性由强至弱的顺序为
Al Ti Cu
.
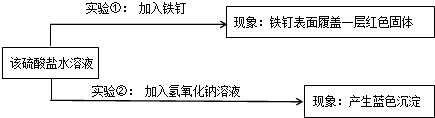
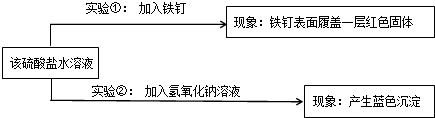
【结论应用】能否用铝制容器来盛装波尔多液(含硫酸铜),
否
(填“能”或“否”);理由是
铝可以和硫酸铜溶液发生反应而腐蚀容器.
.