
题目列表(包括答案和解析)
 人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.| 阴离子 阳离子 |
OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 实验结论 |
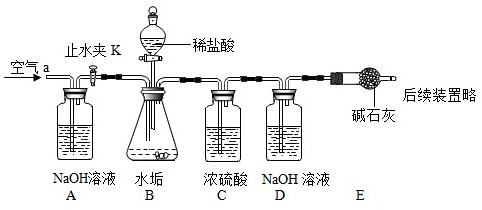
| 在少量研碎的水垢中加入适量的蒸馏水充分搅拌,过滤,再滤液中加入 Na2CO3 Na2CO3 溶液 |
有 白色沉淀 白色沉淀 产生 |
水垢中有 氢氧化钙 |
实验室有一瓶新配制的稀盐酸(HCl气体溶于水得到的混合物为稀盐酸),其标签的部分内容如图所示。
(1)计算该稀盐酸中氯元素的质量分数。
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示。(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数。
实验室有一瓶新配制的稀盐酸(HCl气体溶于水得到的混合物为稀盐酸),其标签的部分内容如图所示。

(1)计算该稀盐酸中氯元素的质量分数。
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示。(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com