
题目列表(包括答案和解析)
 |
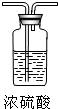 |
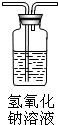 |
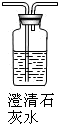 |
| A | B | C | D |
| B装置总质量 | C、D装置总质量 | |
| 反应前 | 156.6g | 356.8g |
| 反应后 | 158.4g | 359.0g |
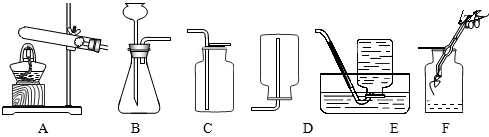
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | / | |
| 2 | 2.0 | CuO 0.5 | |
| 3 | 2.0 | MnO2 0.5 |
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
1-5ADCAB 6-10CDACC 11-15ACDBD 16-20CCDBC 21-22DD
23.化学能 2.52×106 0.06 24.电流 焦耳定律(Q=I2Rt) 大功率用电器交叉使用或换电阻较小的输电线等 25.沿直线传播 折射 缩小
26.(1)B(2)电磁感应(3)三 为了防止用电器漏电造成的触电事故(4)电源线要符合要求;放置电磁炉的桌面要平整,电磁炉在使用中要注意防水防潮,长期不用要拔掉电源线等
27.浓硫酸的密度大于水的密度,浓硫酸溶于水的时候放出热量;将浓硫酸沿容器壁慢慢倒入水中,并不断搅拌
.files/image043.gif) 28.红棕色变浅或消失;漏斗内的液面上升;木炭具有吸附性,使集气瓶内的压强变小
28.红棕色变浅或消失;漏斗内的液面上升;木炭具有吸附性,使集气瓶内的压强变小
29.(1)BCA (2)A,C(3)冷却热饱和溶液
30.(1)3CO+Fe2O3.files/image045.gif) 2Fe+3CO2 (2)Fe3O4 (3)B
2Fe+3CO2 (2)Fe3O4 (3)B
31.(1)Fe H2O (2)Fe+H2SO4=FeSO4+H2↑ 置换反应
32.(1)如右图所示(2)4
33.(1)①相同的酒精灯对等质量的煤油和水加热相同的时间,比较煤油和水升高的温度;
②相同的酒精灯对等质量的煤油和水加热,使它们升高相同的温度比较加热的时间;
(2)为了判断电磁铁磁性的强弱可以让电磁铁去吸引大头针,通过观察电磁铁吸引大头针的个数判断。电磁铁吸引的大头针的数量越多,说明磁性越强
34.(1)弹簧测力计的示数 有刻度部分的长度 V/.files/image029.gif) F
F.files/image029.gif) /V (2)注射器活塞的重力
/V (2)注射器活塞的重力
35.(1)电压表的量程选错;电流表的正、负接线柱接反了;滑动变阻器没有处于最大值;(2)灯丝断开或小灯泡接线柱接触不良(3)右 (4)1.14(5)灯丝的电阻随温度的变化而变化
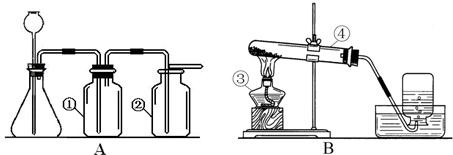
36.(1)CO2 CaCO3+2HCl=CaCl2+H2O+CO2↑ ①③④⑤ (2)O2 铁架台、酒精灯
37.实验一(1)成立(2)反应放出的热量使锥形瓶内的气体膨胀(3)反应放出热量温度达到脱脂棉的着火点,又有氧气生成
实验二(1)质量守恒定律,化学变化前后元素的种类不变;(2)稀盐酸
38.解:设
Fe + H2SO4 FeSO4 + H2↑
56
2
则:56 : 2= x :
钢样中铁的质量分数为: ×100% = 98.6% 答:钢样中铁的质量分数为98.6%。
39.(1)解:由p=F/S可知水泥板对地压强 p=F/S=5000N/
(2)起重机提升水泥板所做的功W=Fs=Gh=5000N×
功率P=W/t=2×105J/10s=2×103 W
.files/image051.jpg) (3)η=W有/W总= Gh / F′s=G/F′n=5000N/(4000N×2)=62.5%
(3)η=W有/W总= Gh / F′s=G/F′n=5000N/(4000N×2)=62.5%
增大 在额外功不变的情况下增大了有用功
40.(1)如右图
(2)处于加热状态时电热丝电阻R1=U2/P1=(220V)2/800W=60.5Ω
处于保温状态时电路总电阻R2= U2/P2=(220V)2/40W=1210Ω
保温元件R工作时的阻值R= R2- R1=1210Ω-60.5Ω=1149.5Ω
(3)电热水瓶内水的质量为m=ρV=1×
烧开一瓶
电热水瓶的热效率为90%,则需要的电能W=Q/η=1.68×106J/ 90%=1.87×106J
需要加热的时间t= W/P=1.87×106J /800W=2333 s
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com