
题目列表(包括答案和解析)
下表是元素周期表的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
![]() (1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(2)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的离子方程式 ▲ ;![]()
(3)元素⑨形成的单质中存在的化学键为 ▲ ;![]()
(4)物质熔沸点的高低与该物质的晶体结构有关,④的单质晶体熔点为2573K,沸点2823K,硬度大,则属于 ▲ 晶体。某同学猜想⑧和⑩形成的化合物B晶体类型与NaCl相同,现用实验证明上述猜想是否正确,你的实验方案是 ▲ 。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)B和F的最高价氧化物对应的水化物中酸性较强的是 (填化学式),写出可以验证该结论的一个离子方程式 。
(2)AE的水溶液可用于刻蚀玻璃,反应的化学方程式为 。
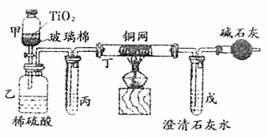 (3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml?L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
(3)小型电镀厂排出的污水中含有剧毒的BC-,可用右图所示装置所理浓缩后的污水(200mL,BC-的浓度为0.05ml?L-1),并测定BC-被处理的百分率。仪器甲中TiO2是催化剂,发生的反应是用过量的NaC1O将BC-氧化成BCD-;甲中反应后的溶液放入乙中,在酸性条件下BCD-继续被NaC1O氧化成C2和BD2
回答下列问题:
①乙中反应的离子方程式为
。
②乙中生成的气体除C2和BD2外,还有HC1及副产物C12等,上述实验是通过测定BD2的量来确定BC-的处理效果。则丙中加入的试剂是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
③戊中盛有过量的澄清石灰水,若实验结束后戊中共生成沉淀0.82g,则该实验中测得BC-被处理的百分率为 。
④某同学对上述实验进行全面的分析后,得出测定结果比实际结果偏低的结论。你认为此结论 (填“正确”或“不正确”)
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | ① | | |||||
| 二 | ② | ③ | ④ | | ⑤ | ⑥ | |
| 三 | | ⑦ | ⑧ | | | ⑨ | ⑩ |
 (1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;




下图是元素周期表的一部分,其中所列字母分别代表某一元素
| a | b | ||||||||||||||||
| j | c | d | |||||||||||||||
| e | f | g | h | ||||||||||||||
| i | k |
⑴写出元素k基态原子的核外电子排布式________________________。
⑵e、f单质及ef形成的合金的硬度由大到小的顺序为_______________(用具体名称回答)。
⑶用来组成酸、碱、盐三类物质至少需要的元素有_________(用表中列出元素的化学式填写)。
⑷短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
|
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:折线a和折线b,你认为正确的是 。
1-5DDBBC 6-10ABCCB 11-15DDCDD 16-20 BBBDC 21-22 CB
23.吸气 变大 不变 24.(1)增大受力面积,减小压强(2)醋 密度大 沸点低
25.折射 虚 反射 虚 26.右 0 27.(1)1.45×1018 (2)6×1010 (3)21%
.files/image057.gif)
.files/image058.gif) 28.(1)B (2)CO2+H2O H2CO3 29.(1)D (2)A (3) 高温下化学性质稳定(或耐高温)(4) 有机高分子材料 30.(1)H2 +O2 H2O (2)化合反应
28.(1)B (2)CO2+H2O H2CO3 29.(1)D (2)A (3) 高温下化学性质稳定(或耐高温)(4) 有机高分子材料 30.(1)H2 +O2 H2O (2)化合反应
.files/image060.gif) 31.(1)H2O CO Ca(OH)2 NH3 CuO (2)CaCO3
31.(1)H2O CO Ca(OH)2 NH3 CuO (2)CaCO3.files/image062.gif) CaO+CO2↑
CaO+CO2↑
.files/image064.gif) 32.如图1
32.如图1
33.(1)电流周围存在磁场;(2)改变运动状态,力的作用是相互的;(3)温度越高,蒸发越快;(4)变化的电流产生电磁波(或收音机接收到电磁波)
34.(1)83.3%,同一滑轮组提升速度相同时,被提升钩码越重,机械效率越大;(2)同一滑轮组,以不同的速度提升相同的重物,机械效率没有改变;(3)滑轮组机械效率与被提升的物重有关,与提升速度无关
35.方法一:(2)①0.6,0~.files/image066.gif)
方法二:(2)①0.6,0~0.files/image068.gif)
36.(1)黑; C+2CuO △ 2Cu+CO2↑ ;变浑浊(2)石灰水倒吸入大试管中,使试管炸裂(3)由黑色变成光亮的紫红色
37.【进行实验】小于 绿色树叶表面出现黄色斑点 镁条和大理石表面有气泡冒出
【反思评价】吸收生成的二氧化硫或中和“酸雨”,减小对环境的污染
【推广应用】影响植物的生长,腐蚀金属制品、建筑物和雕塑等(答案合理即可)
38.(1)2.2
(2)解:设
CaCO3+2HCl=CaCl2+H2O+CO2↑
100
44
.files/image070.gif)
x
石灰石样品中碳酸钙的质量分数 =.files/image072.gif) ×100% = 83.3%
×100% = 83.3%
39.
40.(1)R0=44Ω (2)保温 24.2 W (3)11.2 min
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com