
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,测定溶液pH | pH=0 |
| (2)取少量该溶液加热浓缩,加Cu片和浓 H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加少量BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加足量AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。

(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
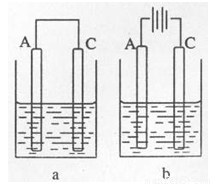
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
![]() 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) ![]() 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)H2(g)+CO2(g)
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)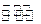 H2(g)+CO2(g)
H2(g)+CO2(g)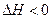 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 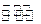 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)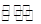 H2(g)+CO2(g)
H2(g)+CO2(g)
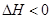 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 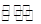 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
一、选择题。
1.AD 2.C 3.A 4.B 5.C 6.A 7.B 8.B 9.C 10.C 11.B 12.D 13.AC?14. B?15.D 16.BD 17.B 18. B 19.C 20.A
二、填空题。
1.19.6%
2.⑴CH4、C2H4、C3H4、CH2O、C2H2O、C3H2O
⑵a
3.―OH;A:CH3CH2CH2OH;B:CH3CH=CH2;C:CH3CH2CHO
4.⑴CnH2nO
⑵醇分子里含有一个碳碳双键或一个碳环
⑶  ;CH2=CHCH2CH2CH2OH
;CH2=CHCH2CH2CH2OH
5.(1) 
(2)C
(3)B (4)C10H16O
(5) 
三、计算题。
1.(1)m(H2O)=
(2)C2H4?
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等)?
2.(1)a=8 L (2)正好完全反应,a= L;若x>2/3,a=10(2x-1)L;
L;若x>2/3,a=10(2x-1)L;
x<2/3,a=10(1-x)L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com