
题目列表(包括答案和解析)
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+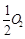 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。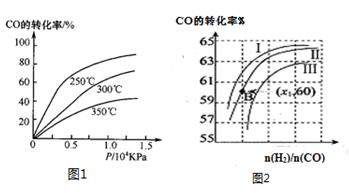
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
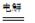 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
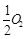 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ① CH3OH(g)。
CH3OH(g)。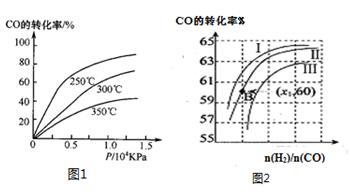
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
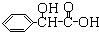 .
.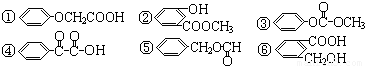
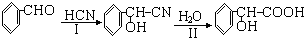
 )氧化生成,写出该反应的化学方程式______
)氧化生成,写出该反应的化学方程式______ )经硫酸催化而生成,写出该反应的化学方程式______
)经硫酸催化而生成,写出该反应的化学方程式______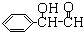 B.M可能是乙二酸
B.M可能是乙二酸
|
某饱和一元醛和酮的混合物共3 g,跟足量的银氨溶液完全反应后可还原出16.2 g银,下列有关说法正确的是 | |
A. |
混合物中可能乙醛 |
B. |
3 g该混合物不可能还原出16.2 g银 |
C. |
混合物中一定有甲醛 |
D. |
混合物中醛和酮的质量比为3∶5 |
一、选择题。
1.AD 2.C 3.A 4.B 5.C 6.A 7.B 8.B 9.C 10.C 11.B 12.D 13.AC?14. B?15.D 16.BD 17.B 18. B 19.C 20.A
二、填空题。
1.19.6%
2.⑴CH4、C2H4、C3H4、CH2O、C2H2O、C3H2O
⑵a
3.―OH;A:CH3CH2CH2OH;B:CH3CH=CH2;C:CH3CH2CHO
4.⑴CnH2nO
⑵醇分子里含有一个碳碳双键或一个碳环
⑶  ;CH2=CHCH2CH2CH2OH
;CH2=CHCH2CH2CH2OH
5.(1) 
(2)C
(3)B (4)C10H16O
(5) 
三、计算题。
1.(1)m(H2O)=
(2)C2H4?
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等)?
2.(1)a=8 L (2)正好完全反应,a= L;若x>2/3,a=10(2x-1)L;
L;若x>2/3,a=10(2x-1)L;
x<2/3,a=10(1-x)L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com