(2013?江宁区一模)对牙膏的探究要用到许多化学知识.
(1)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,某实验小组同学设计了2种转化流程,如下图1所示.
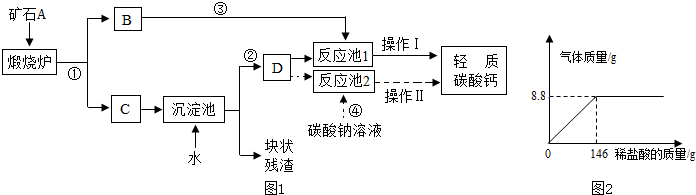
请回答下列问题:
a.小王同学主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.
请写出反应①和④的化学方程式:①
;④
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
;
b.操作Ⅱ包括搅拌、
过滤
过滤
、洗涤、干燥等工序.
c.小李同学认为流程①、②、③和操作I比小王的主张更好,其理由是:
利用产生的二氧化碳比另加碳酸钠溶液更经济,生成成本更低,若产生的二氧化碳不回收直接排放,不利于“节能减排”
利用产生的二氧化碳比另加碳酸钠溶液更经济,生成成本更低,若产生的二氧化碳不回收直接排放,不利于“节能减排”
;
操作I包括搅拌和微热等工序.
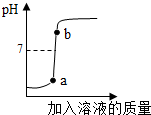
(2)该实验小组为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示.请完成下列计算内容:
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
(写出计算过程)
解:设样品中CaCO
3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
1007344
xy8.8g
根据
=解得x=20 根据
=解得y=14.6g
样品中CaCO
3的质量分数为:
×100%=80%
稀盐酸的溶质质量分数为:
×100%=10%
解:设样品中CaCO
3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
1007344
xy8.8g
根据
=解得x=20 根据
=解得y=14.6g
样品中CaCO
3的质量分数为:
×100%=80%
稀盐酸的溶质质量分数为:
×100%=10%
.

 (2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
(2013?雨花台区一模)实验室欲用已配好的质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),配制100g质量分数为5%的氢氧化钠溶液,并用此溶液测定某硫酸溶液的溶质质量分数.
 请回答下列问题:
请回答下列问题: