
题目列表(包括答案和解析)
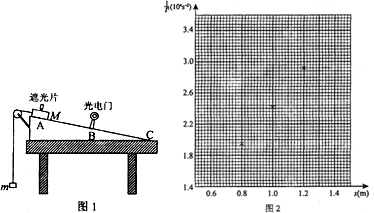
某学生利用“验证机械能守恒定律”的实验装置来测量一个质量m=50 g的钩码下落时的加速度值,该学生将钩码固定在纸带下端,让纸带穿过打点计时器,实验装置如图(a)所示.
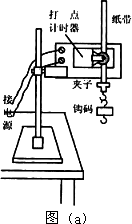
(1)以下是该同学正确的实验操作和计算过程,请填写其中的空白部分:
①实验操作:________________________________;
②取下纸带,取其中的一段标出计数点如图(b)所示,测出相邻计数点间的距离分别为S1=2.60 cm,S2=4.14 cm,S3=5.69 cm,S4=7.22 cm,S5=8.75 cm,S6=10.29 cm,已知打点计时器的打点间隔T=0.02 s,则木块运动的加速度计算表达式为a=________,代入数据,可得加速度a=________m/s2(计算结果保留三位有效数字).
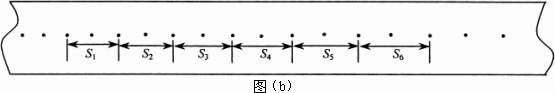
(2)该同学从实验结果发现,钩码下落时的加速度比实际的重力加速度小,为了有效地缩小这个实验测得的加速度与实际的重力加速度之差,请你提出一个有效的改进方法:_______.
| h |
| d |
| h |
| d |
| 1 |
| 2 |
| b2 |
| t2 |
| 1 |
| 2 |
| b2 |
| t2 |
| 1 |
| t2 |
| 1 |
| t2 |
| 2(hM-dm)g |
| (M+m)db2 |
| 2(hM-dm)g |
| (M+m)db2 |
| 1 | 2 | 3 | 4 | 5 | |||
| s(m) | 0.600 | 0.800 | 1.000 | 1.200 | 1.400 | ||
| t(ms) | 8.22 | 7.17 | 6.44 | 5.85 | 5.43 | ||
|
1.48 | 1.95 | 2.41 | 2.92 | 3.39 |
| 1 |
| t2 |
| 1 |
| t2 |
(1) 下列有关几个物理实验的描述中,正确的是( )
A.在用打点计时器“研究匀变速直线运动”的实验中,由纸带上的一系列点迹取计数点,可求出任意两个计数点之间的平均速度
B.在“验证力的平行四边形定则”的实验中,拉橡皮筋的细绳要稍长,并且实验时要使弹簧测力计与木板平面平行,同时保证弹簧的轴线与细绳在同一直线上
C.在“探究物体的加速度与力和质量之间的关系”的实验中,可先保持物体的质量不变,研究物体的加速度与物体所受的合外力之间的关系,再保持物体所受的合外力大小不变再研究物体的加速度与物体的质量之间的关系
D.在“验证机械能守恒定律”的实验中,一定要用天平测出下落物体的质量
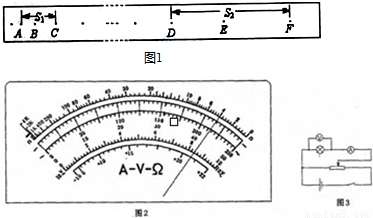
(2)如图是研究物体做匀变速直线运动的实验得到的一条纸带(实验中打点计时器所接低压交流电源的频率为50 Hz),从O点后开始每5个计时点取一个记数点(即相邻两个计数点之间有4个计时点没有画出),依照打点的先后顺序依次编为0、1、2、3、4、5、6,测得s1=5.18 cm,s2=4.40 cm,s3=3.62 cm,s4=2.78cm,s5=2.00 cm,s6=1.22 cm.(保留两位有效数字)
①相邻两记数点间的时间间隔为 s;
②物体的加速度大小a= m/s2,方向 (填A→B或B→A);
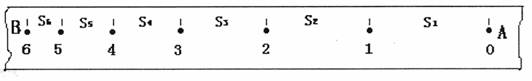 ③打点计时器打记数点3时,物体的速度大小v3= m/s.
③打点计时器打记数点3时,物体的速度大小v3= m/s.
| 1 |
| 2 |
| S | 3 |
| S | 1 |
| 1 |
| 2 |
| S | 3 |
| S | 1 |
| S | 2 |
| S | 2 |
| 1 |
| 8 |
| f | 2 |
| 2 |
| 1 |
| 8 |
| f | 2 |
| 2 |
| 方案编号 | 电阻箱的阻值R/Ω | ||||
| 1 | 400.0 | 350.0 | 300.0 | 250.0 | 200.0 |
| 2 | 80.0 | 70.0 | 60.0 | 50.0 | 40.0 |
| 1 |
| U |
| 1 |
| U |
| 1 | ||
|
| 1 | ||
|
| b |
| k |
| -R | 0 |
| b |
| k |
| -R | 0 |
1.D【解析】β-珠蛋白DNA探针、RNA聚合酶结合位点、大肠杆菌质粒的化学本质都是DNA;胰岛素是蛋白质;HIV的遗传物质是RNA;生长素是吲哚乙酸;2,4-D是一种生长素类似物。
2.D【解析】作物“烧心”是由于缺乏如铁、钙等在细胞中以稳定化合物形式存在的矿质元素,有别于因缺水而造成的“烧苗”。
3.B【解析】疫苗的作用是在机体不患病的情况下发生免疫反应,产生的抗体与抗原结合,发挥免疫效应;流感病毒的遗传物质是单链的RNA,其结构稳定性不如天花病毒的双链DNA,容易发生变异,所以流感疫苗的研究的难度较天花疫苗研究的难度大很多;正是由于流感病毒极易发生变异,所以某种特定的单克隆抗体不一定对其它的抗原起作用。
4.C【解析】生态系统的成分除生产者、消费者和分解者外,还包括了非生物的物质和能量;生物圈的自给自足表现在物质上,能量来源于太阳能;草原上的牛和羊同属于第二营养级,共获得生产者固定太阳能的10%~20%。
5.B【解析】考查分泌蛋白的形成和分泌过程这一知识点和图形分析能力。蛋白质分泌以细胞膜的外排方式实现,所经过的膜结构顺序为:内质网→高尔基体→细胞膜,所以结果是:内质网面积减小,高尔基体膜面积不变,细胞膜面积增加。
6.B 【解析】有机分子的特点一般满足C四键、H一键、N三键原则,三聚氰胺分子中含有3个-NH2,则其余3个C、3个N形成一个六元环,故三聚氰胺的结构简式为。理科综合试题.files/image094.jpg) 。根据三聚氰胺的结构简式,该物质不是高聚物,也不是氨基酸,但分子中含有不饱和键,在一定条件下能发生加成反应。六元环不变且除自身外的三聚氰胺的异构体有3种。
。根据三聚氰胺的结构简式,该物质不是高聚物,也不是氨基酸,但分子中含有不饱和键,在一定条件下能发生加成反应。六元环不变且除自身外的三聚氰胺的异构体有3种。
7.B 【解析】选项A,Na2O2中含有的阳离子为Na+,阴离子为O22?,0.1mol
Na218O2中含有的阴阳离子总数为0.3NA。选项B,C2H4、C3H6的化学式均为CH2,
8.A 【解析】选项A,ClO-具有氧化性,SO2具有还原性,SO2被氧化为SO42?,ClO-被还原为Cl?,正确。选项B,加入少许H+时,CO32?优先与H+结合生成HCO3?。选项C,离子方程式两边电荷不守恒。选项D,Mg2+能与电解产生的OH?结合生成难溶性Mg(OH)2沉淀:Mg2+ + 2Cl? + 2H2O=Mg(OH)2↓+ H2↑+ Cl2↑。
9. B 【解析】加入稀H2SO4出现白色混浊说明一定存在Ba2+,因SO32?、CO32?能与Ba2+结合生成难溶物BaSO3、BaCO3,所以原溶液中不存在SO32?、CO32?。由于溶液呈电中性,剩下的一种HCO3?,一定存在。无法判断是否含有K+,所以原溶液中一定含有Ba2+、HCO3?,可能含有K+。溶质可能是Ba(HCO3)2或Ba(HCO3)2和KHCO3。
10.D 【解析】根据题设条件可推知A为NH4+,B为OH?,C为NH3,D为H2O。NH3能与H2O反应生成NH3?H2O。NH4+为离子,不是分子,所以NH4+不是非极性分子。选项D,固态H2O分子间存在氢键,其熔沸点高于固态H2S,与H-O和H-S键强弱无关。NH4Cl ,NH4+水解溶液的pH<7。
11.C【解析】分析反应①②中各元素的价态变化可知,反应①中,SO2为还原剂,Fe3+为氧化剂,且还原性:SO2>Fe2+,氧化性:Fe3+>SO42?。反应②中,Fe2+为还原剂,Cr2O72?为氧化剂,且还原性:Fe2+>Cr3+ ,氧化性:Cr2O72? > Fe3+。由此可见选项A、B错误。选项C,由于Cr2O72?具有氧化性,Na2SO3具有还原性,故Cr2O72? 能将Na2SO3氧化成Na2SO4。选项D,反应①中Fe2(SO4)3为氧化剂,反应②中Fe2(SO4)3为氧化产物。
12.C【解析】选项A,NaHS、Na2S溶液又因为有HS?、S2?的水解,使其溶液呈碱性,但S2?的水解能力大于HS?,故溶液的pH值:③>②。H2S溶液呈酸性,H2S和NaHS混合液中,由于HS?抑制的H2S的电离,故溶液的pH:④>①,4种溶液pH大小顺序为:③>②>④>①。选项B,由于HS?抑制H2S的电离,所以H2S溶液中的c(H2S)小于H2S和Na2S混合液中的c(H2S)。选项C,c(Na+)=0.1mol?L-1,根据物料守恒有:c(H2S) + c(HS?)
+ c(S2?)=0.2mol?L-1,故
13.B 【解析】设达平衡时生成SO3(g)物质的量为2x ,则剩余SO2(g)的物质的量为(3-2x),O2(g)(2-x),混合气体总的物质的量为(5-x),根据阿伏伽德罗定律有5/(5-x)=1/0.9,解得x=0.5mol,再结合热化学方程式可知,放出的热量为196.6kJ/2=98.3kJ。选项B,起始物质的量改为 4mol SO2 、 3 mol O2 、2SO3 (g) 相当于加入6mol SO2、4mol O2,n(SO2)/n(O2)=3/2,故与第一次平衡是等效平衡,两次平衡中SO2的转化率、SO3的体积分数相等,故选项B正确,C错误。选项D,题目没有告诉达平衡时的时间,无法计算反应速率。
14.AD【解析】由状态方程理科综合试题.files/image096.gif) 知温度升高而压强增大体积必增大,故状态I时气体的密度比状态II时气体的密度大,A正确,平衡态II的温度比状态I高,故状态I时分子的平均动能比状态II时分子的平均动能小,B错误,由热力学第一定律
知温度升高而压强增大体积必增大,故状态I时气体的密度比状态II时气体的密度大,A正确,平衡态II的温度比状态I高,故状态I时分子的平均动能比状态II时分子的平均动能小,B错误,由热力学第一定律理科综合试题.files/image098.gif) 知从状态I到状态II过程中温度升高内能变大,体积增大对外界做功,气体要从外界吸热,故C错,D正确,故选AD。
知从状态I到状态II过程中温度升高内能变大,体积增大对外界做功,气体要从外界吸热,故C错,D正确,故选AD。
15.答案:BD【解析】:在同一介质中红光传播速度最大,从AB面射入到BC面射出,红光用的时间最短,故选项A错.由于玻璃对红光折射率最小,对紫光的折射率最大,即紫光的偏折本领最大,所以彩色光带右边缘的色光为红光,左边缘的色光为紫光,且紫光的频率比红光的要高,当红光能让某金属板发生光电效应,紫光也一定能够,故选项B正确.在同样条件下做双缝干涉实验,波长越长,相邻干涉条纹间距越大,而彩色光带左边缘的色光是紫光,其波长最短,故选项C错.对玻璃而言,在七色光中,红光的临界角最大,当∠MNB逐渐变小时,射到AC面上的光的入射角变小,且红光入射角小得更多,故红光最先从从AC面透出,所以选项D正确.
16、答案 D 【解析】 烧断细线后,无论是弹簧将A+B和C弹开过程,还是A和B分离后,系统始终动量守恒、机械能守恒;弹簧将A+B和C弹开过程,A+B和C动量大小相等,动能跟质量成反比,因此A+B的总动能是E/3,其中A的动能是E/6;当时C的动能是2E/3;前3个选项都错,可判定D正确。证明:A和B分离时,B+C的总动能是5E/6,B、C共速时弹性势能最大,当时A和B+C动量大小相等,动能跟质量成反比,因此B+C的动能是E/12,该过程B+C的动能损失就是此时的弹性势能,因此Ep=5E/6- E/12=3E/4。
17.答案:ACD【解析】:根据波的传播方向,可以判断b质点此时刻振动方向沿y轴负方向,离开平衡位置,速度正在变小,A对;由图象可知该波的波长是理科综合试题.files/image100.gif) 得
得理科综合试题.files/image102.gif) ,由波干涉条件知C正确;经过0.01s即半个周期,任何质点通过的路程都是2个振幅,即
,由波干涉条件知C正确;经过0.01s即半个周期,任何质点通过的路程都是2个振幅,即
18.C【解析】从图(甲)到图(乙)的过程中,根据动能定理有:理科综合试题.files/image104.gif) ,所以
,所以理科综合试题.files/image106.gif) ;从抛出后到落地,根据动能定理得:
;从抛出后到落地,根据动能定理得:理科综合试题.files/image108.gif) ,代入上式可得:
,代入上式可得:理科综合试题.files/image110.gif) 。
。
19.答案: BC 【解析】此模型为类双星模型,两电荷做圆周运动的角速度相等;两个电荷之间的库仑力充当各自做圆周运动的向心力,所以向心力大小相等,A错,B对.由理科综合试题.files/image112.gif) 知,线速度大小与质量成反比,运动半径与质量成反比,C对,D错.
知,线速度大小与质量成反比,运动半径与质量成反比,C对,D错.
20.答案:ABD 【解析】天然放射性元素的半衰期与温度改变无关。根据质能方程计算可知D答案正确。
21.答案:.D 【解析】地球同步卫星是指与地球自转同步的人造卫星,它的周期是24小时,它的轨道平面只能在赤道,理科综合试题.files/image114.gif) 得
得理科综合试题.files/image116.gif) 轨道也是固定的,但并不是说同一赤道平面内的、或是周期与地球自转周期相等的就都是同步卫星,故A、C是错的、D是正确的;同步卫星做圆周运动时,内部的仪器是处于失重状态而不是超重状态,B错
轨道也是固定的,但并不是说同一赤道平面内的、或是周期与地球自转周期相等的就都是同步卫星,故A、C是错的、D是正确的;同步卫星做圆周运动时,内部的仪器是处于失重状态而不是超重状态,B错
22.答案.(1)(g+a)× (OM-ON)=(g-a)× OP (4分)
【解析】利用纸带分析得m1带动m2的加速度为a ,又由牛顿第二定律得a=理科综合试题.files/image118.gif) 解得
解得理科综合试题.files/image120.gif)
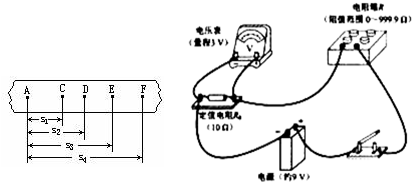
⑴3000;(2分)
⑵丙(1分);乙图中电流表的示数太小,误差太大。丙图中R的阻值与电压表阻值接近,误差小。(3分)。
⑶实物图连接如右图所示:(4分)
⑷实验步骤:
①闭合K1.再闭合K2,读得电压表示数U1;再断开K2,读得电压表示数U2.(2分) ②RV=理科综合试题.files/image122.gif) 。(2分)
。(2分)
23.【解析】:(1)负电……(2分)∵mg =理科综合试题.files/image124.gif)
理科综合试题.files/image126.gif) E×
E×理科综合试题.files/image128.gif) ……(5分)
……(5分)
∴E=4(r+R)dmg/Rq…………(2分)
(2)mg+q v0B=理科综合试题.files/image128.gif)
理科综合试题.files/image130.gif) ……………(5分) ∴v0=mg/qB…………(2分)
……………(5分) ∴v0=mg/qB…………(2分)
理科综合试题.files/image132.gif) 24.【解析】:(1)ab通过最大电流时,受力分析如图甲,此时静摩擦力最大,
24.【解析】:(1)ab通过最大电流时,受力分析如图甲,此时静摩擦力最大,理科综合试题.files/image134.gif) ,方向沿斜面向下,由平衡条件得:
,方向沿斜面向下,由平衡条件得:
水平:
理科综合试题.files/image136.gif) (3分)
(3分)
竖直:理科综合试题.files/image138.gif) (3分)
(3分)
以上两式联立得出理科综合试题.files/image140.gif)
理科综合试题.files/image142.gif) (3分)
(3分)
(2)通以最小电流时,ab受力分析如图乙,此时ab受静摩擦力,方向沿斜面向上,与(1)类似,由平衡条件得:理科综合试题.files/image144.gif) (3分)
(3分)
(3)当ab中电流最小时,变阻器阻值为:理科综合试题.files/image146.gif) (3分)
(3分)
当ab中电流最强时,变阻器阻值为:理科综合试题.files/image148.gif) ,(2分 )
,(2分 )
理科综合试题.files/image150.gif) 为保持ab静止,R的调节范围为0.91~10
为保持ab静止,R的调节范围为0.91~10理科综合试题.files/image152.gif) .(1分)
.(1分)
25.【解析】:(1)设A物块碰撞B物块前后的速度分别为v1和v2,碰撞过程中动量守恒,
理科综合试题.files/image154.gif) 代入数据得:
代入数据得: 理科综合试题.files/image156.gif) (4分)
(4分)
(2)设A、B两物块碰撞前后两物块组成的系统的机械能分别为E1和E2,机械能的损失为理科综合试题.files/image158.gif) ,根据能的转化和守恒定律:
,根据能的转化和守恒定律: 理科综合试题.files/image160.gif)
理科综合试题.files/image162.gif)
理科综合试题.files/image164.gif) %
(4分)
%
(4分)
(3)设物块A的初速度为v0,轮胎与冰面的动摩擦因数为µ,A物块与B物块碰撞前,根据动能定理:理科综合试题.files/image166.gif) (3分)
(3分)
碰后两物块共同滑动过程中根据动能定理:
理科综合试题.files/image168.gif) (3分)
(3分)
由理科综合试题.files/image170.gif) 、
、 理科综合试题.files/image172.gif) 及(1)、(2)得:
及(1)、(2)得:理科综合试题.files/image174.gif) (2分)
(2分)
设在冰面上A物块距离B物块为L′时,A物块与B物块不相撞,
则:理科综合试题.files/image176.gif)
理科综合试题.files/image178.gif) (4分)
(4分)
26.(15分)(1)(1)KNO3 (2分)CuSO4(2分)
(2) Na2CO3 (2分)
(3)Al3+ + 3OH?=Al(OH)3↓(3分) Al(OH)3 + OH?=AlO2? + 2H2O (3分)
(4) Al3+ + 3H2O 理科综合试题.files/image180.gif) Al(OH)3(胶体)+ 3H+ (3分)
Al(OH)3(胶体)+ 3H+ (3分)
【解析】根据实验①可知,D中含有Cu2+;根据实验②可知C中含有Al3+,E可能是KOH或NaOH,再根据③,只有B、C中含有K+,故E为NaOH。根据实验③A中含有HCO3?,故A为NaHCO3,C、D中含有SO42?,故D为CuSO4,C为KAl(SO4)2。
最后可判定B为KNO3。等物质的量的NaHCO3与NaOH反应生成Na2CO3和H2O。 NaOH溶液加入到KAl(SO4)2溶液中,首先是Al3+与OH?反应生成Al(OH)3,Al(OH)3沉淀又溶解在过量的NaOH溶液中:Al3+ + 3OH?=Al(OH)3↓,Al(OH)3 + OH?=AlO2? + 2H2O。KAl(SO4)2中的Al3+水解生成具有吸附作用的Al(OH)3胶体而净水。
27.(14分)(1)Na2CO3 +HCl=NaHCO3 + NaCl (3分)
(2)Cl2 + 2OH?=Cl? + ClO? + H2O (3分)
(3)①Na2O或Na2O2 (4分,每空各2分)②Na或NaOH (4分,每空各2分)
【解析】(1)根据题设条件可知,B为盐酸,C为CO2,D为H2O,E为NaCl。
(2)根据题设条件可知B为浓盐酸,C为Cl2。
(3)若C为O2,D、E的焰色反应均为黄色,D、E中含有Na+,含有Na+的能产生O2的固体为Na2O2,E能与盐酸反应生成的气体能使澄清石灰水变混浊,该气体为CO2,B、E可相互转化,故可推知B溶液为NaHCO3溶液,E为Na2CO3溶液,D为NaOH溶液。Na2O2与NaHCO3溶液反应可分解为:2Na2O2 + 2H2O=4NaOH + O2↑,NaHCO3 + NaOH=Na2CO3 + H2O。amol NaHCO3→a mol Na2CO3,只要增加a mol Na+,同时用OH? 将HCO3?转化为CO32? ,所加物质所产生的Na+和OH?的物质的量相等,才能不产生杂质,故X为Na2O或Na2O2,Y为Na或NaOH。
28.(16分)(1)B(2分) 铜与HNO3反应前,应排净装置内的空气,防止NO与O2发生反应 (2分)
(2)将C中的溶液加适量水稀释(2分)
(3)③④⑤⑨ (3分)
(4)第二,打开a,通足量N2,排净装置中的空气(2分)
(5)向下移动乙管,使甲、乙两管液面在同一水平面上(2分)
(6)(V-11.2n)/33.6n (3分)
【解析】根据实验目的,要求得m值,需测定出Cu与HNO3反应生成的NO2和NO的物质的量,为此需将产生的气体首先通入装置C中,H2O吸收NO2生成NO和HNO3,用装置E测定出NO的体积,如果装置中有空气,空气中的O2会将NO氧化成NO2导致实验误差,装置B通入N2能将装置中空气赶走,防止NO被氧化,为此需要的装置为B、C、E,装置接口连接顺序为③④⑤⑨。由于浓HNO3具有强氧化性,能将指示剂氧化而影响实验,可加水稀释降低其氧化性,而溶质HNO3的量不变,便于观察指示剂颜色变化。用装置E测定NO的体积时,如甲的液面高于乙的液面,测出的NO体积偏小,如甲的液面低于乙的液面,测出的NO体积偏大,故应向下移动乙管,使甲、乙两管液面在同一水平面上,从而减少误差。根据反应:3NO2 + 2H2O=2HNO3 + NO,混合气体中含有NO21.5nmol,NO总的物质的量为V/22.4mol,其中属于Cu与HNO3反应生成的NO为(V/22.4-n/2)mol,故M=(V/22.4-n/2):1.5n=(V-11.2n)/33.6n。
29.(15分)(1)取代(或水解)、中和反应 (2分) (2)HCOOCH3 (2分) HOCH2CHO (2分)
(3)理科综合试题.files/image182.jpg) (2分)
(2分)
(4)理科综合试题.files/image184.jpg) + 3NaOH
+ 3NaOH理科综合试题.files/image186.gif)
理科综合试题.files/image188.jpg) + CH3COONa + 2H2O
(3分)
+ CH3COONa + 2H2O
(3分)
(5)理科综合试题.files/image190.jpg) (2分)
(2分) 理科综合试题.files/image192.jpg) (2分)
(2分)
【解析】A的分子式为C9H8O4,A能与醇发生酯化反应,说明A中含有-COOH,且A在NaOH溶液中发生水解生成CH3COONa,说明A中酯的官能团,该官能团与-COOH处于苯环上的邻位,再结合A的分子式推知A的结构简式为理科综合试题.files/image184.jpg) ,B为
,B为理科综合试题.files/image193.jpg) ,由于H2CO3的酸性大于酚而小于羧酸,故在
,由于H2CO3的酸性大于酚而小于羧酸,故在理科综合试题.files/image194.jpg) 溶液中通入CO2时,只有酚的钠盐反应生成D(
溶液中通入CO2时,只有酚的钠盐反应生成D(理科综合试题.files/image195.jpg) )和NaHCO3。CH3COONa与H+反应生成E(CH3COOH)。CH3COOH的同分异构体中R中含有-CHO和-OH:HOCH2CHO,Q中含有-CHO而没有-OH:HCOOCH3。对照
)和NaHCO3。CH3COONa与H+反应生成E(CH3COOH)。CH3COOH的同分异构体中R中含有-CHO和-OH:HOCH2CHO,Q中含有-CHO而没有-OH:HCOOCH3。对照理科综合试题.files/image190.jpg) 和
和理科综合试题.files/image196.jpg) 结构可知,首先用
结构可知,首先用理科综合试题.files/image198.jpg) 与酚羟基反应,然后再用酸性KMnO4氧化-CH3为-COOH即可得到A。
与酚羟基反应,然后再用酸性KMnO4氧化-CH3为-COOH即可得到A。
30.【解析】(1)新陈代谢是生物最本质的特征。(2)人体内水的来源包括:饮水、食物中的水、代谢产生的水,人体代谢产生水的途径有:核糖体上的氨基酸脱水缩合、线粒体中的有氧呼吸等。(3)异化作用类型包括需氧型、厌氧型和兼性厌氧型,根据材料提供信息,气性坏疽的异化作用类型为厌氧型。(4)本题考查的是细胞的选择透过性,细胞的功能特性决定于细胞膜上的载体的种类和数量
【答案】(12分,每空各2分)(1)新陈代谢现象 (2) 代谢产生水
氨基酸脱水缩合(或有氧呼吸) (3) 厌氧型
(4)选择透过性 载体蛋白
【解析】由反应式:CO2+C5→C3和 理科综合试题.files/image199.gif)
理科综合试题.files/image200.gif) C5+CH2O可知:一定范围内的CO2增加可以使细胞中C3增加;一定范围内的光照增强会导致细胞内C5增加。甲图信息显示:只考虑光照的影响,光照强度为由n增加到k时,光合速率几乎不变,而乙图的变化应是光照之外的其他因素引起,比如温度等
C5+CH2O可知:一定范围内的CO2增加可以使细胞中C3增加;一定范围内的光照增强会导致细胞内C5增加。甲图信息显示:只考虑光照的影响,光照强度为由n增加到k时,光合速率几乎不变,而乙图的变化应是光照之外的其他因素引起,比如温度等
【答案】(10分,每空各2分)(1)低、高、约等于 (2)温度
(3)光照强度、CO2浓度、温度
31.(20分)【解析】:(1)该6个品系玉米的基因型分别为:①:AABBCCDDEE ②:aaBBCCDDEE ③:AAbbccDDEE ④:AABBCCddEE ⑤:AABBCCDDee ⑥:aabbccddee
基因分离定律适用于一对等位基因控制的相对性状的遗传,基因自由组合定律适用于2对(及以上)的同源染色体上的2对(及以上)等位基因控制的性状遗传。具有两对相对性状的纯合亲本杂交,F1自交。若F2中出现性状分离比为:双显∶单显1∶单显2∶双隐=9∶3∶3∶1,则控制这两对相对性状的基因位于2对同源染色体上,反之则位于同一染色体上
让F1侧交,若F2中出现性状分离比为:双显∶单显1∶单显2∶双隐=1∶1∶1∶1,则控制这两对相对性状的基因位于2对同源染色体上,反之则位于同一染色体上
【答案】(1)②与①(③或、④、⑤) (1分) 不行 (1分) 品系①和⑤只有一对相对性状 (2分)不行 (1分) 控制花色和种皮颜色的基因位于同一对同源染色体(Ⅰ)上,而控制子叶味道的基因位置未知(2分)
(2)D(1分)
①若绿色非甜子叶∶绿色甜子叶∶黄色非甜子叶∶黄色甜子叶=9∶3∶3∶1,则控制子叶颜色和味道的基因不是位于同一染色体上。(3分)
②若绿色非甜子叶∶绿色甜子叶∶黄色非甜子叶∶黄色甜子叶≠9∶3∶3∶1(答绿色甜子叶:绿色非甜子叶:黄色非甜子叶=1:2:1也可),则控制子叶颜色和味道的基因位于同一染色体上。(3分)
(3)
①若绿色非甜子叶∶绿色甜子叶∶黄色非甜子叶∶黄色甜子叶=1∶1∶1∶1,则控制子叶颜色和味道的基因不是位于同一染色体上。(3分)
②若绿色非甜子叶∶绿色甜子叶∶黄色非甜子叶∶黄色甜子叶≠1∶1∶1∶1(答绿色甜子叶:黄色非甜子叶=1:1也可),则控制子叶颜色和味道的基因位于同一染色体上。(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com