
题目列表(包括答案和解析)
。 甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:

(1)写出有关化学方程式。
装置甲:____________________________________ ;
装置丁: __________________ 。
(2)证明氯水已饱和的现象是 。
(3)制取结束时,装置丙的液体中含有的微粒是 (用微粒符号表示 );
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是: 。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________
_______________________________________________________________________
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:
(1)写出有关化学方程式。
装置甲:____________________________________;
装置丁: __________________ 。
(2)证明氯水已饱和的现象是 。
(3)制取结束时,装置丙的液体中含有的微粒是 (用微粒符号表示);
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是: 。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________
_______________________________________________________________________
(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
(10分);四只试剂瓶中分别盛装有NaNO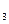 溶液、Na
溶液、Na CO
CO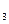 溶液、Na
溶液、Na SO
SO 溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
在 四支试管中分别取四种溶液各1mL,做下列实验。
四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入 (填试剂名称),检验出的物质是 ,发生反应的化学方程式是
(2)在剩余三支试管中分别滴入 (填试剂的化学式),检验出的物质是 ,发生反应的离子方程式是
(3)在剩余两支试管中分别滴入 (填试剂的化学式),检验出的物质是
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
A
A
C
B
A
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
D
C
C
A
D
D
D
B
二、填空题
21.CH4+2O2.files/image015.gif) CO2+2H2O,C3H8+5O2
CO2+2H2O,C3H8+5O2.files/image015.gif) 3CO2+4H2O。
3CO2+4H2O。
缩小进风(通空气)管口径或扩宽进气(CH4)管口径。
因空气过量,会把燃料放出的热量带走而损失。
22.(1)Al2O3 (2)(NH4)2SO4、K2SO4
(3)2AlO.files/image017.gif) +CO2+3H2O===
2Al(OH)3↓+CO32-
+CO2+3H2O===
2Al(OH)3↓+CO32-
23.(1)CH2=CH2+Cl2.files/image019.gif) CH2Cl-CH2Cl
(加成)
CH2Cl-CH2Cl
(加成)
.files/image020.gif)
.files/image021.gif)
.files/image022.gif) (2)nCH3-CH=CH2
(2)nCH3-CH=CH2.files/image019.gif) CH-CH 2 n (加聚)
CH-CH 2 n (加聚)
CH3
.files/image023.gif)
.files/image024.gif) (3)
+HO―SO3H
(3)
+HO―SO3H.files/image026.gif) ―SO3H+H2O (取代)
―SO3H+H2O (取代)
.files/image027.gif) |
(4) -CH3 +3HONO2.files/image029.gif) O2N- -CH3 +3H2O (取代)
O2N- -CH3 +3H2O (取代)
三、实验题
24.溴水或酸性KMnO4溶液;NaOH溶液。
25.(1)盐酸(2)铁(3)氢氧化钠
26.(1)酸性KMnO4溶液或溴水
.files/image030.gif) (2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(3)不同, 不同于 (4)
四、计算题
27.(1)混合气相对分子质量=28.5×2=57,
可推知x为C4H10(相对分子质量58);
Y则为C4H8或C4H6(相对分子质量56或54)
(即“①C4H10与C4H
(2)①若为C4H10与C4H8则得V(C4H10): V(C4H8)=1 : 1
②若为C4H10与C4H6则得V(C4H10): V(C4H6)=3:1 (2分)
28.解答:据图所示(1)x=0.4,则n(Al3+)=0.4×0.1 mol=0.04 mol,Fe3+=0.1 mol-0.4×0.1 mol=0.06 mol
.files/image032.jpg)
由反应
Fe3+ + 3OH-===Fe(OH)3↓
0.06 mol→0.18 mol 0.06 mol
Al3+
+ 4OH-===AlO.files/image034.gif) +2H2O
+2H2O
0.04 mol→0.16 mol
余n(OH-)=
所以有0.06 mol Fe(OH)3沉淀。 (3分)
(2)要使沉淀中无Al(OH)3,至少需n(OH-)=4×0.1 x mol
x为最大取值时,有0.1(1-x)×3 mol+0.4x mol=0.09×4 mol x=0.6
所以在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0,Fe(OH)3沉淀为0.1 mol
x=0.4,Fe(OH)3沉淀为0.06 mol
x=0.6,Fe(OH)3沉淀为0.04 mol
在0.6≤x≤1内沉淀总量n=0.1 mol-(0.09×4-0.1×3) mol=0.04 mol (4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com