
题目列表(包括答案和解析)
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
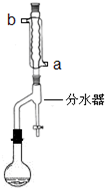 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
| ||
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 |
3.0 | 1.5 | 0 |
| 10min后的浓度 /mol?L-1 |
2.0 2.0 |
1.0 1.0 |
1.0 1.0 |
| 平均反应速率 /mol?L-1min-1 |
0.1 0.1 |
0.05 0.05 |
0.1 |
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
A
A
C
B
A
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
D
C
C
A
D
D
D
B
二、填空题
21.CH4+2O2.files/image015.gif) CO2+2H2O,C3H8+5O2
CO2+2H2O,C3H8+5O2.files/image015.gif) 3CO2+4H2O。
3CO2+4H2O。
缩小进风(通空气)管口径或扩宽进气(CH4)管口径。
因空气过量,会把燃料放出的热量带走而损失。
22.(1)Al2O3 (2)(NH4)2SO4、K2SO4
(3)2AlO.files/image017.gif) +CO2+3H2O===
2Al(OH)3↓+CO32-
+CO2+3H2O===
2Al(OH)3↓+CO32-
23.(1)CH2=CH2+Cl2.files/image019.gif) CH2Cl-CH2Cl
(加成)
CH2Cl-CH2Cl
(加成)
.files/image020.gif)
.files/image021.gif)
.files/image022.gif) (2)nCH3-CH=CH2
(2)nCH3-CH=CH2.files/image019.gif) CH-CH 2 n (加聚)
CH-CH 2 n (加聚)
CH3
.files/image023.gif)
.files/image024.gif) (3)
+HO―SO3H
(3)
+HO―SO3H.files/image026.gif) ―SO3H+H2O (取代)
―SO3H+H2O (取代)
.files/image027.gif) |
(4) -CH3 +3HONO2.files/image029.gif) O2N- -CH3 +3H2O (取代)
O2N- -CH3 +3H2O (取代)
三、实验题
24.溴水或酸性KMnO4溶液;NaOH溶液。
25.(1)盐酸(2)铁(3)氢氧化钠
26.(1)酸性KMnO4溶液或溴水
.files/image030.gif) (2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(3)不同, 不同于 (4)
四、计算题
27.(1)混合气相对分子质量=28.5×2=57,
可推知x为C4H10(相对分子质量58);
Y则为C4H8或C4H6(相对分子质量56或54)
(即“①C4H10与C4H
(2)①若为C4H10与C4H8则得V(C4H10): V(C4H8)=1 : 1
②若为C4H10与C4H6则得V(C4H10): V(C4H6)=3:1 (2分)
28.解答:据图所示(1)x=0.4,则n(Al3+)=0.4×0.1 mol=0.04 mol,Fe3+=0.1 mol-0.4×0.1 mol=0.06 mol
.files/image032.jpg)
由反应
Fe3+ + 3OH-===Fe(OH)3↓
0.06 mol→0.18 mol 0.06 mol
Al3+
+ 4OH-===AlO.files/image034.gif) +2H2O
+2H2O
0.04 mol→0.16 mol
余n(OH-)=
所以有0.06 mol Fe(OH)3沉淀。 (3分)
(2)要使沉淀中无Al(OH)3,至少需n(OH-)=4×0.1 x mol
x为最大取值时,有0.1(1-x)×3 mol+0.4x mol=0.09×4 mol x=0.6
所以在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0,Fe(OH)3沉淀为0.1 mol
x=0.4,Fe(OH)3沉淀为0.06 mol
x=0.6,Fe(OH)3沉淀为0.04 mol
在0.6≤x≤1内沉淀总量n=0.1 mol-(0.09×4-0.1×3) mol=0.04 mol (4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com