
题目列表(包括答案和解析)
(1)在元素周期表第三周期中,性质最活泼的金属所形成晶体的堆积模型是 ,配位数为 。
(2)根据VSEPR模型, H2O的立体结构为 形,中心原子的杂化轨道类型是 ;含有8个质子,10个中子的原子的化学符号为_______;周期表中电负性最大的元素为_______;最外层电子排布为4s24p1的原子的核电荷数为________。
(3)下列7种物质:①白磷(P4);②水晶;③氯化铵;④氢氧化钙;⑤氟化钠;⑥过氧化钠;⑦石墨,固态下都为晶体,回答下列问题(填写序号):不含金属离子的离子晶体是________,既含范德华力,又有非极性键的晶体是____,熔化时既要克服范德华力,又要破坏化学键的是___。
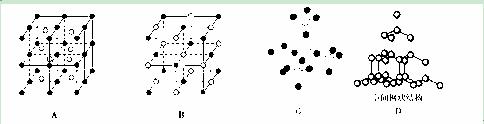
(4)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
B.________;D.__________。

(08上海12校第二次联考)用NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.标准状况下,2.24升苯中约含有0.6NA个碳原子
B.1.8克铵根离子中含有的电子数为NA
C.25℃时,1LpH=13的氢氧化钾溶液中约含有NA个氢氧根离子
D.在铜与硫的反应中,1mol铜失去的电子数为2NA
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
一、选择题(本题共10分),每小题2分,只有一个正确选项。
|