
题目列表(包括答案和解析)
NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
(08长沙雅礼中学二模)设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.0.1molFe与0.1molCl2充分反应,转移的电子数为0.3NA
B.标准状况下,11.2LNO2和11.2LN2O4的混合物所含的分子数为1.5NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.0.25molNa2O2中含有的阴离子数约为0.25×6.02×1023
B.1 mol·L -1 Mg(NO3)2溶液中含有NO3-的数目约为2×6.02×1023
C.2.24LCH4中含有的原子数约为0.5×6.02×1023
D.标准状况下,22.4 L 乙醇中所含的分子数约为6.02×1023
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
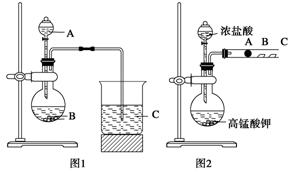
根据图1回答:
(1)写出选用物质的名称:A________ ____ ,B_____ _____ ,C_____ _______ ;
(2)烧瓶中反应的离子方程式为_______________________________________________
烧杯中反应的离子方程式为_______________________________________________。
根据图2回答:
(3)乙同学的实验原理是______________________________________________ _
(4)B处的实验现象是______________________________________________ _;
(5)B处的反应的离子方程式: ___________________________________________ _ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com