
题目列表(包括答案和解析)
(10分)单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+ 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由
。
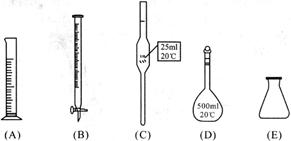
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。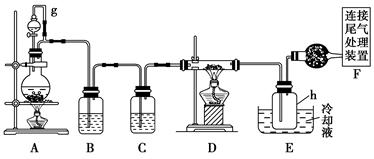
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知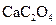 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 | 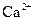 | 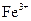 |
| 完全沉淀时的pH | 13 | 4.1 |
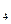 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: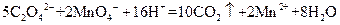 。
。
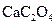 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作: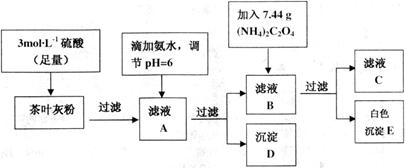
| 离子 | 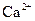 | 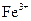 |
| 完全沉淀时的pH | 13 | 4.1 |
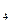 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: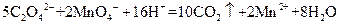 。
。
1.B 2.A 3.D 4.D 5.B 6.C 7.A 8.C 9.D 10.A
11.A 12.C 13.A 14.D 15.B 16.D 17.A
18.(8分)(1)碳(1分) (2)  (1分) (3)Cl->O2->Na+ (2分)
(1分) (3)Cl->O2->Na+ (2分)
(4)离子键和共价键(2分)(说明:可不答配位键)
(5)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(2分)
NH3↑+CO32-+2H2O(2分)
19.(6分)(1) NaHSO4、NaAlO2 (3分) (2) BaCl2、MgCl2、NaHCO3(3分)
20. (6分)(1)刚开始时溶液变为蓝色,随着氯水的继续加入,溶液的蓝色褪去,最终变为浅黄绿色。(2分)
(2)Cl2 + 2I- = 2Cl- + I2 (2分) 5Cl2 + I2 + 6H2O = 10Cl- +2IO3- + 12H+ (2分)
(说明:第2个离子方程式可不配平)
21.(8分)(1)催化(1分) 氧化(1分)
(2)KClO3(1分) H2O2(1分)
(3)MnO2+4HCl(浓) MnCl2+C12↑+2H2O(2分)
MnCl2+C12↑+2H2O(2分)
(4)Fe3O4+8H+ = Fe2++2 Fe3++ 4H2O(2分)
22.(12分)(1)① b c a c d(2分)
吸收未反应的NH3,防止空气中的水蒸气进入(第二个c 装置中)(2分)
②2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O(2分)
2NH3↑+CaCl2+2H2O(2分)
③ -16 (2分) ④AC (2分)
-16 (2分) ④AC (2分)
(2) AC (2分)
23.(9分)(1)H++OH―=H2O(1分)
NH4++OH― NH3↑+H2O(1分)
NH3↑+H2O(1分)
(2)0.84(2分) (3)1:4 (2分)
(4)Ⅲ(1分) 5 mol?L-1 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com