
题目列表(包括答案和解析)
钛被称为继铁、铝之后的第三金属.如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
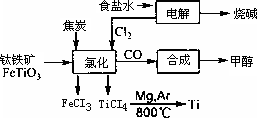
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是________.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:________.
(3)已知:①Mg(s)+Cl2(g)=MgC12(s) ΔH=-641 kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) ΔH=________.
反应2Mg(s)+TiCl4(s)![]() 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是________.
2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是________.
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是________.
钛(Ti)被称为继铁、铝之后的第三金属.如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
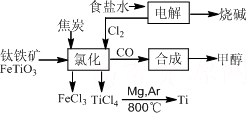
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是________.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:________.
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s) ΔH=-770 kJ·mol-1
则2Mg+TiCl4=2MgCl2+Ti ΔH=________.
反应2Mg(s)+TiCl4(s)![]() 2MgCl2(s)+Ti在Ar气氛中进行的理由是________.
2MgCl2(s)+Ti在Ar气氛中进行的理由是________.
(4)在上述产业链中,合成192 t甲醇理论上需额外补充H2________t(不考虑生产过程中物质的任何损失).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是________.
钛被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
 请填写下列空白:
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
。
(3)已知:①.Mg(s)+Cl2(g)=MgC12(s) △H=-641kJ·mol-1
②Ti(s)+2C12(g)=TiCl4(s) △H=-770kJ·mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)十Ti(s) △H= 。
|
反应2Mg(s)+TiCl4(s) 2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是
。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
(l)电解饱和食盐水时,总反应的离子方程式是 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程 。
(3)已知:①Mg(s)+ Cl2(g)=MgCl2(s) △H=-641kJ·mol-1
②Ti(s)+ 2Cl2(g)=TiCl4(s) △H= -770kJ·mol-1
则2Mg(s)+ TiCl4(s)=2MgCl2(s) + Ti(s) △H= 。
反应2Mg(s)+ TiCl4(s)![]() 2MgCl2(s)+ Ti,在Ar气氛中进行的理由是: ______________________________________ 。
2MgCl2(s)+ Ti,在Ar气氛中进行的理由是: ______________________________________ 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
钛(Ti )被称为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:


(l)电解饱和食盐水时,总反应的离子方程式是 。
 (2)写出钛铁矿经氯化法得到四氯化钛的化学方程
。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程
。
(3)已知:①Mg(s) + Cl2(g)=MgCl2(s) △H =-641kJ·mol-1
 ②Ti(s)
+ 2Cl2(g)=TiCl4(s) △H
= -770kJ·mol-1
②Ti(s)
+ 2Cl2(g)=TiCl4(s) △H
= -770kJ·mol-1
则2Mg(s) + TiCl4(s)=2MgCl2(s) + Ti(s) △H= 。
 反应2Mg(s)
+ TiCl4(s)
反应2Mg(s)
+ TiCl4(s) 2MgCl2(s)
+ Ti,在Ar气氛中进行的理由是:
______________________________________
。
2MgCl2(s)
+ Ti,在Ar气氛中进行的理由是:
______________________________________
。
 (4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是
。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是
。
1.B【解析】植物细胞原生质层成为半透膜决定于细胞膜的选择透过性,其结构特性――流动性与其半透膜特性无关;下丘脑细胞是甲状腺素的靶细胞,促甲状腺激素的靶细胞是甲状腺细胞;细胞新陈代谢的主要场所是细胞质基质而不是细胞器;二倍体生物细胞有丝分裂后期染色体数目应是4的整数倍。
2.D【解析】本题考查了细胞质遗传、基因的结构、基因突变等相关知识。质粒是基因工程中目的基因的运载体,而氨基酸的运输工具是tRNA;DNA分子中脱氧核苷酸的改变可能发生在非遗传效应的片段,而基因是有遗传效应的DNA片段;花斑紫茉莉的花斑枝条上叶肉细胞中的质体分布情况有3种:只含叶绿体、只含白色体、同时含有叶绿体和白色体;花斑紫茉莉的母本一定是花斑紫茉莉,花斑紫茉莉为母本的子代可能是绿色、白色、花斑色紫茉莉。
3.C【解析】由于植物的根对生长素的敏感性高于茎的敏感性,抑制根生长的生长素浓度对茎可能起促进作用;离体培养的小鼠细胞失去调节体温能力,温度将通过影响酶的活性对小鼠细胞的呼吸产生影响;生态系统稳定性包括抵抗力稳定性和恢复力稳定性,其中抵抗力稳定性与物种丰富度成正相关关系。
4.C【解析】本题考查了植物组织培养、植物体细胞杂交、动物细胞融合以及单克隆抗体的制备等。愈伤组织细胞由成熟植物细胞脱分化形成,细胞中缺少叶绿体等进行自养生活所需结构,其同化作用应为异养型;动物细胞融合后的杂种细胞经培养最终得到一个细胞系,不能得到一个完整个体,所以不可能得到新品种;同种植物体细胞得到染色体数目加倍的生物,该生物与原生物属于不同物种,因为有生殖隔离形成;效应B细胞是单个存在的,用于单克隆抗体制备时不需用胰蛋白酶处理。
5.C【解析】S区不位于中央前回;体温调节中枢也不位于大脑皮层内侧面,而是位于下丘脑;神经调节的基本方式是反射而不是反射弧,反射弧是反射的结构基础。
6. B由于氯气的密度比空气小,低洼处聚集的氯气量大,所以人群应该向着高处紧急疏散。漂白粉的主要成分为CaCl2、Ca(ClO)2,在酸性环境中,Cl?、ClO?发生氧化氧化还原反应而产生氯气:Cl? + ClO? + 2H+=Cl2↑+ H2O。 由于NaOH具有很强的腐蚀性且对环境产生影响,所以不能用NaOH浓溶液吸收释放的氯气,但可以用Ca(OH)2溶液处理。漂白粉中的Ca(ClO)2与空气中的H2O、CO2反应生成CaCO3、HClO,HClO分解而变质,所以发生漂白粉.漂白粉长时间放置在露天仓库中发生变质只发生了两个化学反应。综合上述选项B正确。
7. B 【解析】加入过量盐酸,NO3?(H+)氧化S2?而导致NO3?和S2?的数目大大减少,而SiO32-、AlO2?与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+与过量的OH?反应生成SiO32-和AlO2?。
8.A 【解析】A中铜电极是活性电极,先放电,总方程式没有体现;B中少量SO2生成SO32? ,正确;C中当KOH过量时,1molCa(HCO3)2发生反应要符合组成,生成1mol CaCO3沉淀,还要生成1molCO32―。
9.C【解析】分析反应①、②、③中各元素的价态变化,反应①中KMnO4为氧化剂,H2O2为还原剂,O2为氧化产物,故氧化性:KMnO4>O2。反应②中各种元素价态没有发生变化,是非氧化还原反应,反应③锰、氟元素的价态都发生了变化,是氧化还原反应。根据反应关系有:1mol F2~2mol MnF4~2mol K2MnF6~2molKMnO4,每生成1mol F2,反应①转移6mol 电子,反应③转移2mol 电子,故共转移8mol电子。反应①、②、③所列的物质中不存在碱。综合上述只有选项C正确。
10.A 【解析】根据表给信息,元素Z、Q元素的最低价态均为-2价,说明它们原子的最外层电子数相同,均为6,再根据其原子半径可推知Z为S,Q为O。L最低化合价为-1,原子最外层有7个电子,且有正价,故L为Cl。M的半径较小但大于Q,再结合其它信息可得M为C,X为Mg,Y为Al。选项A,C原子最外层有4个电子,既不易失电子也不易得电子。选项B,Al的金属性比Mg落,与盐酸反应时,Mg更为剧烈。选项C,CO不能被NaOH溶液吸收。选项D,S、Cl原子的电子层数相同,S的非金属性比Cl弱,氢化物的稳定性H2S<HCl。
11.C 【解析】选项A,因HCO3?的水解能力大于CH3COO?水解能力,故同浓度下,NaHCO3溶液的pH值比CH3COONa大。选项B,等体积的pH=3的H2SO4与pH=11的NH3?H2O混合后,NH3?H2O过量,溶液呈碱性。选项C,因FeCl3、Fe(NO3)3发生水解,蒸干过程中生成的HCl、HNO3挥发,促使Fe3+水解彻底而得到Fe(OH)3灼烧时Fe(OH)3分解得到Fe2O3。选项D,CH3COOK溶液中含有CH3COO?、K+、H2O、H+、OH?、CH3COOH。
12、B 先确定5个碳原子的饱和一元羧酸的结构,丁基有四种结构,因此5个碳原子的饱和一元羧酸也有四种结构,其中碳骨架为理科综合试题.files/image067.jpg) 的羧酸,羧基相连的碳原子上无氢原子,氨基无法取代,故分子式为C5H11O2N的同分异构体中,属于α―氨基酸的有3种结构。
的羧酸,羧基相连的碳原子上无氢原子,氨基无法取代,故分子式为C5H11O2N的同分异构体中,属于α―氨基酸的有3种结构。
13.B【解析】左图可以看出改变温度物质浓度变化应从原点突变然后渐变,而30min时A、B、C浓度均减小,当属扩大容器体积,而且平衡没有移动,说明x=1,从右图看出40min时速率均高于平衡时,且υ(逆)>υ(正),故为升温,正反应为放热反应。0~8min内△c(A)=(2.0―1.36)mol/L=0.64 mol/L,所以υ(A)=理科综合试题.files/image069.gif) 。20min~30min时间内,A、B、C的浓度不再变化,反应处于平衡状态,正反应速率等于逆反应速率。
。20min~30min时间内,A、B、C的浓度不再变化,反应处于平衡状态,正反应速率等于逆反应速率。
14.答案:D【解析】气体体积变小时,单位体积的分子数增多,单位时间内打到器壁单位面积上的分子数增多,不能确定分子平均动能的变化,故不能确定气体压强的变化。气体的压强取决于分子的平均动能和分子数密度。气体的温度升高时,分子的平均动能增大,撞击器壁时对器壁的作用力增大,但不能确定分子数密度的变化,所以气体压强不一定增大。压缩一定量的气体,外界对气体做功,吸、放热情况未知,不能确定内能的变化。对一定量的气体,体积增大,即分子数密度减小,而压强增大,则分子的平均动能增大。所以D选项正确
15、答案C【解析】根据全反射临界角的公式理科综合试题.files/image071.gif) ,可知折射率越大,临界角越小;在同一介质中紫光的折射率比其它可见光的折射率大,所以紫光发生全反射的临界角最小。故选项C正确。
,可知折射率越大,临界角越小;在同一介质中紫光的折射率比其它可见光的折射率大,所以紫光发生全反射的临界角最小。故选项C正确。
16.答案:BCD【解析】理科综合试题.files/image030.gif) 和
和理科综合试题.files/image028.gif) 互为同位素,故有相同的质子数,不同的核子数,所以选项A的说法错误.本题的正确选项为BCD.
互为同位素,故有相同的质子数,不同的核子数,所以选项A的说法错误.本题的正确选项为BCD.
17. B D【解析】由于AC段的路程未知,只知道质点在AB段和BC段的平均速度,不能确定质点在AC段的运动时间,A项错误。根据平均速度定义可得理科综合试题.files/image073.gif) ,故B项正确。由于AB段和BC段的运动时间不能确定,故质点运动的加速度不能确定,C项错误。根据匀变速直线运动的特点:
,故B项正确。由于AB段和BC段的运动时间不能确定,故质点运动的加速度不能确定,C项错误。根据匀变速直线运动的特点:理科综合试题.files/image075.gif) ,
,理科综合试题.files/image077.gif) ,
,理科综合试题.files/image079.gif) 可求出
可求出理科综合试题.files/image081.gif) ,D项正确。
,D项正确。
18.答案:BD【解析】:当拉力为F时,对重物而言,由牛顿第二定律有,F-mg=ma
当拉力突然减半时,若理科综合试题.files/image083.gif) >mg,则重物所受合力的方向向上,大小为
>mg,则重物所受合力的方向向上,大小为理科综合试题.files/image085.gif) <
<理科综合试题.files/image087.gif) ,即加速度小于
,即加速度小于理科综合试题.files/image038.gif) .若
.若理科综合试题.files/image083.gif) <mg,则重物所受合力的方向向下,大小为
<mg,则重物所受合力的方向向下,大小为理科综合试题.files/image089.gif) ,F′合有可能等于
,F′合有可能等于理科综合试题.files/image087.gif) ,此时加速度等于
,此时加速度等于理科综合试题.files/image038.gif) .故正确选项为B、D.
.故正确选项为B、D.
19.答案:AD【解析】:由于波源O的起振方向沿y轴负方向,而t=0.7s,x轴上在0~理科综合试题.files/image091.gif) ,而波长λ=
,而波长λ=理科综合试题.files/image093.gif) 有,波的周期为0.4s,所以选项A正确,选项C错.在t=0.7s时刻,质点A处于正的最大位移处,其速度为零,故选项B错.从质点A开始振动到t=0.7s,A振动了
有,波的周期为0.4s,所以选项A正确,选项C错.在t=0.7s时刻,质点A处于正的最大位移处,其速度为零,故选项B错.从质点A开始振动到t=0.7s,A振动了理科综合试题.files/image095.gif) T,故质点A通过的路程是
T,故质点A通过的路程是
20、答案 BC 【解析】:当A B间距增大时,电容器电容减小,电容器要放电,二极管阻止放电。即电容器电量不变,极板间电场强度不变,所以不管小球带正电还是带负电,小球受力情况不变,仍打在N点;反之,当A B间距减小时,电容器电容增大,电容器要充电,充电电流方向与二极管方向相同,即电容器电量增加,极板间电场强度增加,小球受的电场力变大,若小球带正电,则小球受到的电场力方向向下,竖直方向加速度变大,将打在N点左侧。若小球带负电,则小球受到的电场力方向向上,竖直方向加速度变小,将打在N点右侧。
21.答案:B.【解析】在0~t1内,磁通量减少,所以PQ受到沿斜面向上的安培力逐渐减小,此时向下的静摩擦力逐渐减小.当安培力等于mgsinθ时,摩擦力为零,当安培力小于mgsinθ时静摩擦力反向向上逐渐增大,在t1时刻安培力为零,Ff=mgsinθ
22.(18分)理科综合试题.files/image096.gif) 答案Ⅰ.
答案Ⅰ.
Ⅱ.(1)右侧(3分);(2)理科综合试题.files/image098.gif) (4分);(3)如图所示(3分);B,D(2分)
(4分);(3)如图所示(3分);B,D(2分)
解析Ⅰ.重力势能的减小量为:理科综合试题.files/image100.gif) J,重锤下落到B点时的速度为
J,重锤下落到B点时的速度为理科综合试题.files/image102.gif) m/s,重锤下落到B点时增加的动能为
m/s,重锤下落到B点时增加的动能为理科综合试题.files/image104.gif) J,在误差允许的范围内,重物的重力势能减少量和动能的增加量相等,达到了验证的目的。
J,在误差允许的范围内,重物的重力势能减少量和动能的增加量相等,达到了验证的目的。
Ⅱ.(1)若温度t1<t2,由电阻R随摄氏温度t变化的关系图线可知,R1<R2,由理科综合试题.files/image106.gif) 可知I1>I2,则t1的刻度应在t2的右侧;
可知I1>I2,则t1的刻度应在t2的右侧;
(2)由闭合电路的欧姆定律可知,理科综合试题.files/image108.gif) ,又R=R0+kt,联立可知所测温度t与电流I的关系式t=
,又R=R0+kt,联立可知所测温度t与电流I的关系式t=理科综合试题.files/image098.gif) ;
;
(3)用“半偏法”测电流表内阻Rg的电路如图所示,应用半偏法测安培表内阻时,为了能读出Rg的电阻,电阻箱应选B,因滑线变阻器的总电阻应远大于Rg,所以滑线变阻器应选D。
23.解析(1)设行星质量为m,恒星质量为理科综合试题.files/image110.gif) ,行星的公转周期为
,行星的公转周期为理科综合试题.files/image112.gif) ,公转轨道半径为
,公转轨道半径为理科综合试题.files/image114.gif) ,则根据万有引力定律和牛顿第二定律可得:
,则根据万有引力定律和牛顿第二定律可得:理科综合试题.files/image116.gif) ,(3分)
,(3分)
可解得:理科综合试题.files/image118.gif) (2分)
(2分)
设太阳的质量为理科综合试题.files/image120.gif) ,地球绕太阳的公转周期为
,地球绕太阳的公转周期为理科综合试题.files/image122.gif) ,公转轨道半径为
,公转轨道半径为理科综合试题.files/image124.gif) ,
,
同理可得:理科综合试题.files/image126.gif) (2分)
(2分)
故恒星质量与太阳质量之比为:理科综合试题.files/image128.gif) ,代入数据可解得:
,代入数据可解得:理科综合试题.files/image130.gif) (2分)
(2分)
(2)设行星绕恒星运行的速率为理科综合试题.files/image033.gif) ,则有
,则有理科综合试题.files/image133.gif) ,可得:
,可得:理科综合试题.files/image135.gif) (3分)
(3分)
设地球绕太阳的运行速率为理科综合试题.files/image035.gif) ,同理可得:
,同理可得:理科综合试题.files/image138.gif) (2分)
(2分)
行星绕恒星的公转速率与地球绕太阳的公转速率之比为理科综合试题.files/image140.gif) (2分)
(2分)
代入数据可解得:理科综合试题.files/image142.gif) (2分)
(2分)
24.答案.(1)理科综合试题.files/image144.gif) (2)
(2)理科综合试题.files/image146.gif) (2)
(2)理科综合试题.files/image148.gif)
【解析】:(1)粒子在电场中偏转:在垂直电场方向理科综合试题.files/image150.gif) ,平行电场分量
,平行电场分量理科综合试题.files/image152.gif)
理科综合试题.files/image154.gif) ① (2分)
① (2分) 理科综合试题.files/image156.gif) ② (2分)
② (2分)
即:理科综合试题.files/image158.gif) 得
得理科综合试题.files/image160.gif) (1分)
(1分)
粒子在磁场中做匀速圆周运动, 故穿出磁场速度:理科综合试题.files/image160.gif) ③ (1分)
③ (1分)
(2)在电场中运动时 理科综合试题.files/image163.gif) ④ (2分)
④ (2分)
得 理科综合试题.files/image165.gif) (1分)
(1分)
在磁场中运动如图所示
理科综合试题.files/image167.jpg)
运动方向改变45°,运动半径理科综合试题.files/image169.gif) ⑤ (2分)
⑤ (2分)
又理科综合试题.files/image171.gif) ⑥ (2分)
⑥ (2分)
得 理科综合试题.files/image146.gif) (1分)
(1分)
(3)粒子在电场中运动时间:理科综合试题.files/image174.gif) ⑦ (2分)
⑦ (2分)
粒子在磁场中运动时间:理科综合试题.files/image176.gif) ⑧ (2分)
⑧ (2分)
所以在电磁磁场中运动的总时间t=理科综合试题.files/image178.gif) ⑨ (2分)
⑨ (2分)
25.【解析】.(1)A、B两球碰撞过程动量守恒,即Mv0=MV+mv (4分)
根据已知:M=
方向与B球碰撞前的速度方向相同。(3分)
(2)A球对B球所做功的大小等于B球动能的减少量
所以A球对B球所做功的大小为:W=理科综合试题.files/image180.gif) Mv02-
Mv02-理科综合试题.files/image180.gif) MV2=0.96mv02
………(5分)
MV2=0.96mv02
………(5分)
(3)设A、B两球发生第二次碰撞的位置距墙壁为x,则A球以1.2v0的速度运动的距离为s+x,B球以0.6 v0运动的距离为s ? x,A、B两球运动的时间相等,…(2分)
则有:理科综合试题.files/image183.gif) …………(4分)
…………(4分)
解得两球发生第二次碰撞的位置距墙壁:理科综合试题.files/image185.gif) …………(2分)
…………(2分)
26.(15分)(1)P (1分)第四周期第VIA族 (2分)
(2)SiO2 + 2OH? =SiO32- + H2O (2分)
(3)c (2分) (4)②:还原性(2分) ③:H2SeO3 + Br2 + H2O=H2SeO4 + 2HBr(2分)
④酸性(2分) ⑤:H2SeO3 + 2NaOH=Na2SeO3 + 2H2O(2分)(其它合理答案也可)
【解析】(1)根据性质①②,最外层有4个电子的短周期元素为碳、硅,而元素C、D、E在同一周期,假设C为碳,则E为氧,单质氧不能在空气中燃烧,C为硅,D为磷,E为硫,单质硫能在空气中燃烧生成SO2,F为硒。Se元素的原子序数为34,Se原子核外34个电子分4层排布,且与氧同族,据此可判断在周期表中的位置。
(2)Si的最高价氧化物为SiO2,SiO2能与NaOH溶液反应生成Na2SiO3和H2O:SiO2 + 2OH? =SiO32- + H2O。
(3)根据题设条件,推知A为Mg,B为Al。Mg通常显+2价,Al通常显+3价。Mg的活泼性比Al强。产生等量的H2,Mg、Al失去电子数相等,即可得出消耗Mg、Al单质的物质的量比为3:2。
(4)H2FO3为H2SeO3,根据H2SO3的性质推测出H2SeO3具有氧化性、还原性、酸性、不稳定性等。H2SeO3具有氧化性可与具有较强的还原性物质如HI反应:H2SeO3 + 4HI=Se↓+ 2I2 + 3H2O,H2SeO3具有还原性可与具有较强的氧化性物质如溴水反应:H2SeO3 + Br2 + H2O=H2SeO4 + 2HBr。H2SeO3具有酸性可以与碱如NaOH反应:H2SeO3 + 2NaOH=Na2SeO3 + 2H2O。
27.(14分)(1)2Cl?
+ 2H2O 理科综合试题.files/image187.gif) 2OH? + H2↑+ Cl2↑(3分)
2OH? + H2↑+ Cl2↑(3分)
(2)2FeTiO3 + 理科综合试题.files/image189.gif) 2TiCl4
+ 2FeCl3 + 6CO (3分)
2TiCl4
+ 2FeCl3 + 6CO (3分)
(3)C(2分)
(4)10t (3分)
(5)CH3OH-6e- + 8OH?=CO32? + 6H2O (3分)
【解析】(1)电解食盐水生成NaOH、H2和Cl2,反应的离子方程式为:2Cl? + 2H2O
理科综合试题.files/image187.gif) 2OH? + H2↑+ Cl2↑。
2OH? + H2↑+ Cl2↑。
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为:2FeTiO3 +
理科综合试题.files/image189.gif) 2TiCl4
+ 2FeCl3 + 6CO。
2TiCl4
+ 2FeCl3 + 6CO。
(3)C
选项A,Mg不是在O2中燃烧,故641kJ/mol不能称其燃烧热。选项B,反应Ti(s)
+ 2Cl2(g)=TiCl4(s)为放热反应,1mol Ti(s)和2mol
Cl2 (g)的总能量大于1mol TiCl4 (s)的总能量。选项C,假设质量均为理科综合试题.files/image191.gif) =385kJ,故正确。选项D,该冶炼过程使用了有毒Cl2,对环境有影响。
=385kJ,故正确。选项D,该冶炼过程使用了有毒Cl2,对环境有影响。
(4)根据CO + 2H2 →CH3OH,CH3OH~CO~7/6Cl2~7/6 H2,所以生产理科综合试题.files/image193.gif) =10t。
=10t。
(5)CH3OH失去电子为原电池的负极,CH3OH燃烧时生成的CO2被KOH吸收生成K2CO3,故负极上的电极反应为:CH3OH-6e- + 8OH?=CO32? + 6H2O。
28.(14分)(1)BC (2分)Cu(OH)2既能溶于稀硫酸,又能溶于NaOH溶液 (2分)
(2)Cu2O(2分);高于
(3)干燥NH3(2分)
3CuO + 2NH3 理科综合试题.files/image195.gif) 3Cu +
N2 + 3H2O (3分)
3Cu +
N2 + 3H2O (3分)
【解析】(1)要证明Cu(OH)2有两性需观察Cu(OH)2是否既溶解在酸中也能溶解在碱中,故选用的药品为NaOH溶液、稀硫酸。如Cu(OH)2具有两性,Cu(OH)2溶解在NaOH溶液中得到澄清溶液,溶解在稀硫酸中生成蓝色溶液。
(2)理科综合试题.files/image197.jpg)
理科综合试题.files/image199.gif) Cu2O
+
Cu2O
+ 理科综合试题.files/image201.gif) O2↑[1mol CuO可得0.5mol(
O2↑[1mol CuO可得0.5mol(
(3)CuO变为红色物质,说明CuO与NH3反应时生成了Cu,无水CuSO4变蓝,说明有H2O生成,另一种物质为N2,其反应为:3CuO +
2NH3 理科综合试题.files/image195.gif) 3Cu + 6H2O + N2↑。通入的NH3中可能含有H2O而干扰实验,所以装置A中的碱石灰的作用是用于除去NH3中的H2O。
3Cu + 6H2O + N2↑。通入的NH3中可能含有H2O而干扰实验,所以装置A中的碱石灰的作用是用于除去NH3中的H2O。
29.(17分)(1) a、b、e (3分)
(2)① 加成反应 (2分) ② 3 (3分)
(3) ① 保护碳链中的“C=C”不被氧化(3分)
②
理科综合试题.files/image203.jpg) (3分)
(3分)
理科综合试题.files/image205.jpg) (3分)
(3分)
【解析】(1)能发生双烯合成反应的有机物中必修含有类似1,3-丁二烯(CH2=CH-CH=CH2)的结构,比较题给有机物可知a、b、e中含有碳碳单、双键交替的结构,能发生双烯合成反应。
(2)(HCHO)1分子乙炔(CH≡CH)中的2个H原子分别与1分子甲醛(HCHO)中碳氧双键发生加成反应可得HOCH理科综合试题.files/image207.jpg)
(3)HOCH理科综合试题.files/image209.jpg) ),这样C=C双键得以保护,防止被氧化。
),这样C=C双键得以保护,防止被氧化。理科综合试题.files/image209.jpg) 被催化氧化生成C(
被催化氧化生成C(理科综合试题.files/image211.jpg) ),
),理科综合试题.files/image212.jpg) 被催化氧化生成D(
被催化氧化生成D(理科综合试题.files/image214.jpg) ),
),理科综合试题.files/image214.jpg) 在NaOH醇溶液中发生消去反应生成E(HOOC-CH=CH-COOH),HOOC-CH=CH-COOH与CH2=CH-CH=CH2发生双烯合成生成F(
在NaOH醇溶液中发生消去反应生成E(HOOC-CH=CH-COOH),HOOC-CH=CH-COOH与CH2=CH-CH=CH2发生双烯合成生成F(理科综合试题.files/image216.jpg) ),
),理科综合试题.files/image216.jpg) 与HOCH2CH2CH2CH2OH发生缩合反应生成M(
与HOCH2CH2CH2CH2OH发生缩合反应生成M(理科综合试题.files/image218.jpg) )。
)。
30.(22分)【解析】实验一、二考查的是多倍体育种相关知识,实验三考查的是植物体细胞杂交。二倍体生物经秋水仙素处理后成为四倍体生物,二倍体和四倍体属于不同物种,因为它们杂交产生不育的三倍体。萝卜-甘蓝B减数分裂能产生可育的配子;当植物细胞处于质壁分离状态时,可以通过机械切除细胞壁获得原生质体;过程②表示植物组织培养过程,这一过程主要由脱分化和再分化构成;C的基因型为AaBb,A的可能基因型为:AABB、AAbb、aaBB、aabb。实验二中经秋水仙素处理后的萝卜基因型为AAaa,它产生的配子可能有3种:AA、Aa、aa;同理经秋水仙素处理的甘蓝也可能产生3种配子:BB、Bb、bb。所以萝卜-甘蓝B可能有9种基因型
答案:(1)F1产生配子时,萝卜和甘蓝的染色体之间不能配对,不能产生可育的配子(3分)
(2)不是(2分) 可育(1分) 36(2分)
(3)纤维素酶和果胶酶(2分) 防止原生质体因过度吸水而破裂(2分) 质壁分离(2分)
(4)植物细胞的全能性 (2分) 脱分化和再分化(2分)
(5)0 (2分) 9 (2分)
31.(20分)【解析】本题考查对照实验相关知识。关键在于对照建立过程中遵循单一变量原则。利用题目提供的信息理解实验过程中反应的发生以及实验的检测手段
在淀粉酶作用下,非还原糖淀粉分解成有还原性的麦芽糖,淀粉存在可以用碘液检测出来,还原糖可以用斐林试剂检测。检测到还原糖存在说明反应发生了,即酶有活性;检测到淀粉存在说明反应未发生或反应不完全,分别对应于酶完全失活或保留部分活性。(六)小题考查学生思维发散能力以及思维严密性
答案:(四)(2)淀粉糊(2分)等量的存量酶制剂(2分)
(4)向试管A1、B1加入等量碘液,向试管A2、B2加入等量新制的斐林试剂(2分)
(5)将试管B1、B2水浴加热,观察各试管中颜色变化(2分)
(五)(9分)
B1
B2
结论
第一种可能
蓝色
无砖红色沉淀
该存量酶制剂完全失活
第二种可能
蓝色
有砖红色沉淀
该存量酶制剂保留部分活性
第三种可能
褐色
有砖红色沉淀
该存量酶制剂活性正常
(六)没有考虑到该酶制剂与唾液中酶的浓度的可能差异;没有考虑到该淀粉酶与唾液淀粉酶在催化效率之间可能存在的差异(其他合理答案也给分)(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com