
题目列表(包括答案和解析)

| 3 | 7 |
 如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
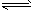 2EB2(g)+O2(g)
2EB2(g)+O2(g) 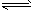 2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。
2EB3(g);△H=-197kJ/mol 若将隔板固定在中央,且x=1,达平衡时右室的压强是起始时的0.7倍,则左室反应的平衡常数K=_______________。 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 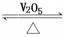 2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
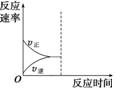
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
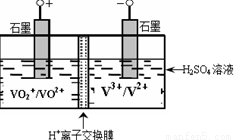
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的物质的量为1 mol。则下列热化学方程式正确的是( )
| A.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-196.6 kJ·mol-1 |
| B.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 |
题号
1
2
3
4
5
6
7
8
答案
C
D
B
B
D
C
A
A
题号
9
10
11
12
13
14
答案
CD
AD
C
A
BD
B
15、(本题共10分)
(1)CO32-水解成碱性,Cu2+与OH‑结合生成Cu(OH)2 (合理给分)。 (2分)
(2)取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净。(2分)
(3)CuSO4、澄清石灰水 (每个1分,名称和化学式搞混不给分,共2分)
(4)B中无水硫酸铜变蓝,澄清石灰水不变浑浊(每点1分,共2分)
(5)装置中原有的空气有影响;实验结束后装置中残留的气体不能被吸收;石灰水可能会吸收空气中的CO2。(2分,说出二点即可)
16、(本题共8分)
(1)腐蚀建筑物、桥梁、工业设备、运输工具;直接破坏农作物、草原、森林;使土壤、湖泊酸化。(说出其中二点即可)(2分)
(2)铁粉和稀硫酸(2分)
(3) 2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+ (2分)
(4) FeSO4?7H2O (2分)
17、(本题共10分)
(1) A D (每个1分,共2 分,有错不给分)
(2) A
(3) X=2 (2分) , A (2分)
(4) 1/1620(或6.17×10-4) (2分)
18.(10分)
(1)重金属离子会使蛋白质变性(2分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (2分)
(3)② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;
曝晒对Cr元素浸出影响不明显;
……
19、(共12分)
(1)消去反应 (1分)
(2) 、CH3CHO、
、CH3CHO、 (每空1分,共3分)
(每空1分,共3分)
(3)CH3COOCH2CH3、CH3CH2COOCH3、CH3CH2CH2COOH、(CH3)2CHCOOH
(对一个得1分,错一个倒扣1分,共4分)
(4)CH3CH(OH)CH(OH)CH3 +
(5) (2分)
(2分)
 20.(10分)
20.(10分)
⑴ 16.8 (2分)
⑵NO3―
(每个2分,共6分)
(3)解:3Fe2+ + NO3- + 4H+ = 3Fe3++NO↑+2H2O
0.3mol 0.6mol 0.2mol
Fe2+、NO3-过量,故产生NO气体:0.2mol÷4×
21.(每小题2分,共12分)
(1)H2S、NH2- (2)A (3)BC
(4)3d104s1 Cr (5)共价键、配位键
(6)降低Cu(NH3)4SO4?H2O的溶解度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com