
题目列表(包括答案和解析)




(13分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与![]() 分子互为等电子体的微粒 (填1种)。
分子互为等电子体的微粒 (填1种)。
(2)水分子在特定条件下容易得到一个![]() ,形成水合氢离子(
,形成水合氢离子(![]() )。下列对上述过程的描述不合理的是 。
)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)![]() 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(6)实验过程中加入![]() 后可观察到析出深蓝色
后可观察到析出深蓝色![]() 晶体。实验中所加
晶体。实验中所加![]() 的作用是__________________________________________________
的作用是__________________________________________________
(13分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入 极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1) 写出与
写出与 分子互为等电子体的微粒 (填1种)。
分子互为等电子体的微粒 (填1种)。
(2)水分子在特定条件下容易得到一个 ,形成水合氢离子(
,形成水合氢离子( )。下列对上述过程的描述不
)。下列对上述过程的描述不 合理的是 。
合理的是 。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________ 后可观察到析出深蓝色
后可观察到析出深蓝色 晶体。实验中所加
晶体。实验中所加 的作用是__________________________________________________
的作用是__________________________________________________(13分)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与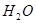 分子互为等电子体的微粒
(填1种)。
分子互为等电子体的微粒
(填1种)。
(2)水分子在特定条件下容易得到一个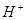 ,形成水合氢离子(
,形成水合氢离子(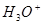 )。下列对上述过程的描述不合理的是
。
)。下列对上述过程的描述不合理的是
。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)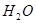 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_____________
(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:
_______________________________;_______________________________。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。
(6)实验过程中加入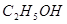 后可观察到析出深蓝色
后可观察到析出深蓝色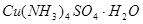 晶体。实验中所加
晶体。实验中所加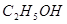 的作用是__________________________________________________
的作用是__________________________________________________
题号
1
2
3
4
5
6
7
8
答案
C
D
B
B
D
C
A
A
题号
9
10
11
12
13
14
答案
CD
AD
C
A
BD
B
15、(本题共10分)
(1)CO32-水解成碱性,Cu2+与OH‑结合生成Cu(OH)2 (合理给分)。 (2分)
(2)取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净。(2分)
(3)CuSO4、澄清石灰水 (每个1分,名称和化学式搞混不给分,共2分)
(4)B中无水硫酸铜变蓝,澄清石灰水不变浑浊(每点1分,共2分)
(5)装置中原有的空气有影响;实验结束后装置中残留的气体不能被吸收;石灰水可能会吸收空气中的CO2。(2分,说出二点即可)
16、(本题共8分)
(1)腐蚀建筑物、桥梁、工业设备、运输工具;直接破坏农作物、草原、森林;使土壤、湖泊酸化。(说出其中二点即可)(2分)
(2)铁粉和稀硫酸(2分)
(3) 2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+ (2分)
(4) FeSO4?7H2O (2分)
17、(本题共10分)
(1) A D (每个1分,共2 分,有错不给分)
(2) A
(3) X=2 (2分) , A (2分)
(4) 1/1620(或6.17×10-4) (2分)
18.(10分)
(1)重金属离子会使蛋白质变性(2分)
(2)① Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2分)
② Cr3+ + 4OH- = CrO2- + 2H2O (2分)
③ 8~10 (2分)
(3)② (以下任意2条即可)(2分)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高;
酸性环境对Cr元素浸出有抑制作用;
冻融对Cr元素浸出影响不明显;
曝晒对Cr元素浸出影响不明显;
……
19、(共12分)
(1)消去反应 (1分)
(2) 、CH3CHO、
、CH3CHO、 (每空1分,共3分)
(每空1分,共3分)
(3)CH3COOCH2CH3、CH3CH2COOCH3、CH3CH2CH2COOH、(CH3)2CHCOOH
(对一个得1分,错一个倒扣1分,共4分)
(4)CH3CH(OH)CH(OH)CH3 +
(5) (2分)
(2分)
 20.(10分)
20.(10分)
⑴ 16.8 (2分)
⑵NO3―
(每个2分,共6分)
(3)解:3Fe2+ + NO3- + 4H+ = 3Fe3++NO↑+2H2O
0.3mol 0.6mol 0.2mol
Fe2+、NO3-过量,故产生NO气体:0.2mol÷4×
21.(每小题2分,共12分)
(1)H2S、NH2- (2)A (3)BC
(4)3d104s1 Cr (5)共价键、配位键
(6)降低Cu(NH3)4SO4?H2O的溶解度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com