
题目列表(包括答案和解析)
 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
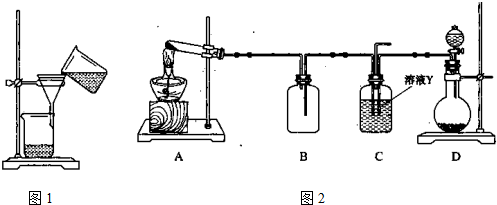
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:
回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: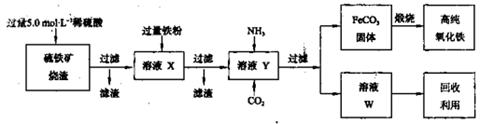
回答下列问题: (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
D
C
C
B
B
二、选择题
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
D
C
D
B
D
D
A
C
三、选择题
题号
21
22
23
24
25
26
27
28
29
30
答案
BC
BD
BD
D
B
C
C
A
BC
BD
题号
31
32
33
34
答案
BC
B
AB
D
 四、填空、简答和计算
四、填空、简答和计算
 35. (1)
(2)
35. (1)
(2)
 |
(3)
(4)BaCO3+2H+==Ba2++CO2↑+H2O
 |
 (5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
(5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
36.(1)Li 原子失去一个电子后, Li+已经形成了稳定结构,此时再失去电子很困难。
(2) C ;(3) ⅢA族,失去第四个电子时所需能量远远大于失去前三个电子所需能量 。
37.(1)产生白色沉淀,试液变成红色;因为在水中SO2和Cl2反应生成盐酸和硫酸,使石蕊试液变红色,硫酸与BaCl2溶液反应产生BaSO4 沉淀。 (2)③、SO3;②、HCl;①、SO2;③、H2O。
38.(14分)(1)碳、氧、钠、硫(2)CO2+2OH-=H2O+CO32-
(3)
 。
。
39.⑴SiO2 Na2SiO3 H2SiO3
⑵

40.(1)
含有SO 或SO
或SO 中的一种或两种都有。
中的一种或两种都有。
(2) BaCO3;(3)
Br-、S2-
; HCO (除SO
(除SO 或SO
或SO 以外)
以外)
41.(1)Al;H2 ;Cl2(2)非金属;
(3)氧化物或氢化物;SiO2+ Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
42.(1) 、
、 ;
; (2)
(2) ;
; 、
、 (3)
(3) 、
、 ;
;
43.解: 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
(Y+16)g 2mol
∴ =
=
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
44.解:
由方程式可知: =n(被还原的
=n(被还原的 )
)


45. (1)a≤2/3;(2)a≥2; (3) 2/3<a<2, (1?a/2)mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com