
题目列表(包括答案和解析)
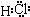
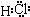
| ||
| ||
| ||
| ||
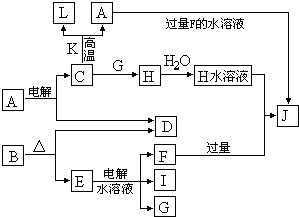
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:

请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F →J的离子方程式: 。
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成 原子个数比为1:1的共价化合物,请写出其分子式: ;
原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:

请填空:
(1) D与I能形成原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
一、选择题(本题共16个小题,每小题3分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
B
A
D
D
题号
9
10
11
12
13
14
15
16
答案
B
B
A
C
B
D
B
D
|