W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
(1)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出C的结构简式为:
CH3COOCH2CH3
CH3COOCH2CH3
.
(2)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式:
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
.
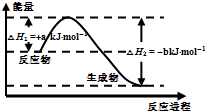
(3)XW
4是一种重要能源物质,如图是1.01×10
5Pa下,1mol XW
4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
;
(4)向50mL 4mol?L
-1的NaOH溶液中通入4.48L元素X的最高价氧化物(标准状况),反应后溶液呈
碱性
碱性
,填(“中性”、“酸性”、或“碱性”),理由是(用离子方程式表示):
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.
(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W
4Y
2Z
3,则该溶液中离子浓度由大到小的顺序为:
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.









 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题: