
题目列表(包括答案和解析)
废弃电池带来的环境污染问题日益突出,已知镍镉
(Ni-Cd)电池中发生的化学反应为:

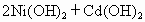
其中
 和
和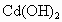 均难溶于水,但能溶于酸.
均难溶于水,但能溶于酸.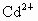 和
和 是重金属离子,对人体有害.
是重金属离子,对人体有害.
(1)
镍镉电池充电时,其能量转化是由________能转化为________能.(2)
一节废镍镉电池会使 耕地失去使用价值,在酸性土壤中这种污染尤为严重,这是什么原因?
耕地失去使用价值,在酸性土壤中这种污染尤为严重,这是什么原因?
(3)
废弃的镍镉电池产生的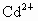 污染可导致人体患骨痛病及肝、肾、肺的病变,
污染可导致人体患骨痛病及肝、肾、肺的病变,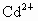 进入人体的途径如图所示:
进入人体的途径如图所示:
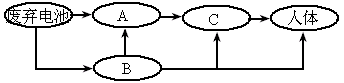
A
、B、C代表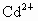 污染传递的载体,如果A代表土壤,则B代表________,C代表________.
污染传递的载体,如果A代表土壤,则B代表________,C代表________.
(4)
你认为减少甚至消除废电池污染,应采取的措施有哪些?废弃电池带来的环境污染问题日益突出,已知镍镉
(Ni-Cd)电池中发生的化学反应为: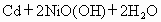


其中
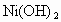 和
和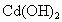 均难溶于水,但能溶于酸.
均难溶于水,但能溶于酸.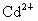 和
和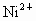 是重金属离子,对人体有害.
是重金属离子,对人体有害.
(1)
镍镉电池充电时,其能量转化是由________能转化为________能.(2)
一节废镍镉电池会使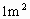 耕地失去使用价值,在酸性土壤中这种污染尤为严重,这是什么原因?
耕地失去使用价值,在酸性土壤中这种污染尤为严重,这是什么原因?
(3)
废弃的镍镉电池产生的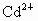 污染可导致人体患骨痛病及肝、肾、肺的病变,
污染可导致人体患骨痛病及肝、肾、肺的病变,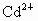 进入人体的途径如图所示:
进入人体的途径如图所示:
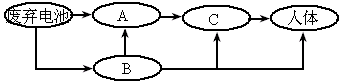
A
、B、C代表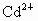 污染传递的载体,如果A代表土壤,则B代表________,C代表________.
污染传递的载体,如果A代表土壤,则B代表________,C代表________.
(4)
你认为减少甚至消除废电池污染,应采取的措施有哪些?
| |||||||||||||||||||||||||||||
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.CO是从煤的气化或合成气得到的.
(1)煤的气化主要反应有:
①2C+O2=2CO ②C+H2O=CO+H2 ③CO+H2O=CO2+H2
上述反应属于化合反应的是________(填序号),属于氧化反应的是________(填序号).
(2)合成气可通过天然气的重整得到,如CH4+H2O=CO+3H2合成气可制二甲醚,二甲醚被称为21世纪的新型燃料.合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如下:
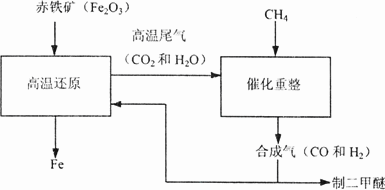
①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制的.用合成气制二甲醚时,还产生了一种可参与大气循环的、常温为液态的氧化物,写出该反应的化学方程式:________.
②合成气在冶炼铁的生产过程中所起的作用是________.
(3)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数.
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化).

①实验中持续通入干燥的氮气.加热前缓缓通入一段时间,其作用是________.
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?
________.
③如果氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的质最变化测定出氧化铁的质量分数将________(选填“偏大”、“偏小”或“准确”),原因是________.
Ⅱ.乙同学取矿石样品10 g,加入足量稀盐酸,完全反应后,共用去稀盐酸109.5 g过滤得到滤渣2 g(假设杂质既不溶于水也不与酸发生反应).请你和乙同学-起计算赤铁矿石中氧化铁的质量分数和反应后溶液中溶质的质量分数.(请写出计算过程).
下表是NaCl和KCl的溶解度数据,请回答下列问题。
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.2 |
| KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
(1)40℃时,氯化钠的溶解度是 g。
(2)将80℃时, 同质量的NaCl和KCl的饱和溶液,分别冷却到0℃,析出晶体最多的是_ (填“NaCl”或“KCl”)溶液。
(3)20℃时,向两只分别盛有35 g NaCl和KCl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是 ,其溶液的溶质质量分数是______(精确到0.1%)。
(4)温度不变的情况下,若要将接近饱和的KCl溶液变成饱和溶液,可采用的方法是_______________。(写一种)
 Ⅱ.(6分)阅读下列三段材料,回答问题:
Ⅱ.(6分)阅读下列三段材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
 材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为
5.94g·cm-3,从而验证了元素周期表的正确性。随后科学家根据元素
周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于
制造半导体材料。镓的原子结构示意图如右图所示。
(1)镓元素的质子数为__________,其氯化物的化学式为_____________。
(2)请根据上述材料,小结金属镓的有关知识:
① 物理性质:镓是银白色金属,密度为5.94g·cm -3
-3
② 化学性质(请用化学方程式表示):_____________________________________;
③ 用途:____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com