
题目列表(包括答案和解析)
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。
[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]
试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂。相关信息如下图所示。同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究。

[提出问题]实验室中久置的碱石灰样品的成分是什么?
[进行猜想] 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分。用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 (写一个)
[探究过程]

试回答下列问题:
(1)操作①的名称是 ,溶液C中一定含 离子。
(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 ,反应的方程式为 。
(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 。
[实验结论]
依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 (填序号)
①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种
[拓展延伸]
为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请分析计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。从钠元素质量守恒的角度解释其原因是: 。
【解析】[进行猜想]生成氢氧化钙的方程式为CaO+H2O═Ca(OH)2 生成碳酸钠的方程式为2NaOH+CO2═Na2CO3+H2O
[探究过程]
(1)将固液分离的操作为过滤,酚酞变红了,说明溶液显碱性,故溶液中一定含有OH—
(2)能与氯化钙反应的是碳酸钠,其反应方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓
(3)可以取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,则说明CaCl2溶液已过量
[实验结论]因为加水后烧杯壁变热说明样品中含有氢氧化钠或者是氧化钙,或者是二者都有,加入氯化钙生成白色沉淀说明样品中一定含有碳酸钠,综合以上分析,故选②③
[拓展延伸]
(1)根据质量守恒定律可求出反应产生的CO2的质量为200g+200g-395.6g=4.4g
(2)根据二氧化碳的质量为4.4克就可以计算了,根据化学反应方程式计算,即可得出样品中碳酸钠的质量,继而得出原样品中氢氧化钠的质量,具体步骤见答案。
(3)氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸


过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验装置中,当倾倒二氧化碳时,发现了
现象;同时也惊奇地发现棉花团燃烧了起来。
【提出问题】棉花团为什么会燃烧起来呢?
【查阅资料】
(1)在常温下Na2O2能和CO2反应生成一种气体和碱性物质。
(2)在常温下Na2O2能和水发生反应: 2Na2O2+2H2O═4NaOH+O2↑
(3)无水硫酸铜为白色固体,吸水后变为蓝色。
【设计实验】经过讨论后,小组同学设计了如图2的实验进行探究。
【实验步骤】
①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的小木条,观察现象。
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响。
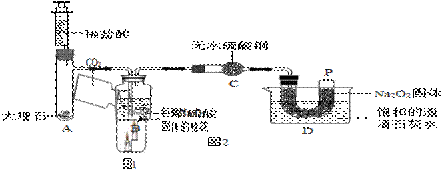 |
【实验现象】
①无水硫酸铜 ;②带火星的小木条复燃;③ 。
【实验分析】
(1)“小木条复燃”说明Na2O2和CO2反应生成了 ;实验现象③说明该反应放出了热量;同时棉花团是可燃物,棉花团因为同时满足燃烧所需的三个条件,所以燃烧起来了。
(2)请你写出Na2O2和CO2反应的化学方程式
【拓展提高】
同学们在实验室发现一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量。
 【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是________________________的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物……
【设计实施方案】
| 实验步骤 | 实验现象 |
| ①取15 g变质粉末于一支大试管内,加入适量的水,共收集到1.6g气体,然后用带火星木条检验生成的气体。 | 固体完全溶解,有气泡产生,带火星的小木条复燃 |
| ②继续向上述试管中加入足量的石灰水,充分反应。 | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体5g。 |
①取15 g变质粉末于一支大试管内,加入适量的水,共收集到1.6g气体,然后用带火星木条检验生成的气体。 固体完全溶解,有气泡产生,带火星的小木条复燃
②继续向上述试管中加入足量的石灰水,充分反应。 有白色沉淀生成
③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体5g。
【解释与结论】同学们经过认真计算分析,确定了粉末中含有的成分及质量
计算过程:
【反思与评价】
(1)实验室在保存过氧化钠时应注意密封保存。
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH。你认为该方案是否合理并说明理由
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com