
题目列表(包括答案和解析)
(8分)碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
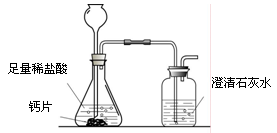
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
(8分)碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。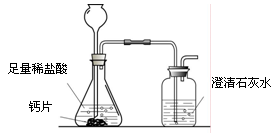
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
(7分)某兴趣小组对上述固体酒精充分燃烧后残留的白色固体的成分进行丁如下探究。
【查阅资料】
(1)醋酸钙[Ca(Ac)2],不可燃.不助燃.易溶于水,溶于水时温度无显著变化;
(2)醋酸钙受热分解生成碳酸钙和有特殊气昧的丙酮;
【猜想与假设】
假设l:白色固体中含有Ca(Ac)2: 假设2:白色固体中含有CaC03
假设3:白色固体中含有Ca0 假设4:白色固体中含有Ca(OH)2
【实验探究】
实验①:取少量白色固体溶于足量蒸馏水中,过滤,得到溶液和白色不溶物,
实验②:取①中滤液于试管中,滴入2滴酚酞试液.溶液变为红色;
实验③:取①中滤液于试管中,滴加碳酸钠溶液,有白色沉淀生成。
【交流讨论】
(1)根据实验①,甲同学认为假设2成立.理由是: ;
(2)根据实验②,乙同学认为假设4成立。丙同学认为假设4不一定成立,但假设3成立.
因为丙同学在实验①中还发现: 。
(3)仅根据实验③,丁同学认为假设3或假设4成立.但戍同学反对.理由是: ;
(4)欲确认假设I成立,还需进行如下实验:
【反思提高】
写出实验③中有关反应的化学方程式: 。
下表是3种物质在不同温度时的溶解度,根据表格信息答题。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
| Ca(OH)2 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 | 0.07 |
(1)某饱和溶液随温度升高有固体析出,则该饱和溶液的溶质是 (填化学式)。
(2)要配制20℃时的NaCl饱和溶液100g,需要NaCl的质量为 g(保留小数点后一位)。
(3)某KNO3晶体中有少量NaCl、Ca(OH)2杂质,要得到纯净KNO3的方法是:先加热溶解,然后 ,过滤、洗涤、干燥后得到KNO3晶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com