
题目列表(包括答案和解析)
将物质的量浓度都为amol/L的X2和Y2置于密闭容器中,在一定条件下发生反应:
mX2(g)+2Y2(g) ![]() PZ(g),达平衡时,测得容器中C(X2)=0.1mol/L,C(Y2)=0.9mol/L,C(Z)=0.8mol/L,下列关于a的数值和Z的化学式推断正确的是:( )
PZ(g),达平衡时,测得容器中C(X2)=0.1mol/L,C(Y2)=0.9mol/L,C(Z)=0.8mol/L,下列关于a的数值和Z的化学式推断正确的是:( )
①1.3 、X2Y4 ②1.7 、XY3 ③1.7 、X4Y2 ④1.3 、X3Y
A.① ② B.③ ④ C.① ③ D.② ④
将物质的量浓度都为amol/L的X2和Y2置于密闭容器中,在一定条件下发生反应:
mX2(g)+2Y2(g) ![]() PZ(g),达平衡时,测得容器中C(X2)=0.1mol/L,C(Y2)=0.9mol/L,C(Z)=0.8mol/L,下列关于a的数值和Z的化学式推断正确的是:( )
PZ(g),达平衡时,测得容器中C(X2)=0.1mol/L,C(Y2)=0.9mol/L,C(Z)=0.8mol/L,下列关于a的数值和Z的化学式推断正确的是:( )
①1.3 、X2Y4 ②1.7 、XY3 ③1.7 、X4Y2 ④1.3 、X3Y
A.① ② B.③ ④ C.① ③ D.② ④
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
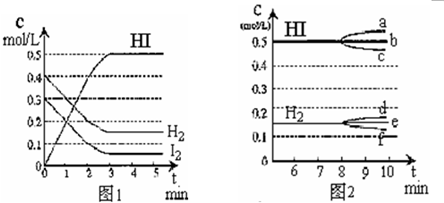
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
一、二、选择题
题号
1
2
3
4
5
6
7
8
9
答案
A
B
D
C
B
C
A
D
C
题号
10
11
12
13
14
15
16
17
18
答案
AC
BD
BD
B
A
CD
D
BD
C
三、本题包括3小题,共33分
19.(10分)⑴CO2+NH3+NaCl+H2O=NaHCO3↓+ NH4Cl(2分)
⑵ ①稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收; (1分)
②烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收. (1分)
⑶①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后回到原来位置,说明气密性良好(1分)

(2分)
⑷①减少二氧化碳在水中的溶解,减小实验误差(1分)
②读数前将广口瓶与量筒之间导管中的水转入量筒;(1分)读取量筒中水的体积时要平视(1分)
20.(12分)⑴SO2 (g) + O2(g)
O2(g) SO3(g);△H ? 98.3 kJ/mol(2分)
⑵提高二氧化硫的转化率(2分)
⑶

 给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
⑷ 或 × 100%(2分)
⑸(3分)
 21.(共11分)
21.(共11分)
I.⑴ 2Cu(NO3)2 2CuO+4NO2↑+O2↑(2分)
 ⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
Ⅱ.⑴ 4HNO3浓 4NO2↑+O2+2H2O(2分)
⑵不正确。(1分)带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。(1分)
Ⅲ.用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。(2分)
四.(本题包括3小题,共33分)
22.(共10分)
⑴ (1)A ⑵CD ⑶熟石灰(1分) 2CaSO4? H2O+3H2O===2CaSO4?2H2O(2分)
H2O+3H2O===2CaSO4?2H2O(2分)
⑷S=C=O(2分)
⑸ NH3+HCl===NH4Cl(2分)
23.(10分)
⑴HClO4>H2SO4>H2CO3(2分)
⑵N2H4+4OH--4e-=N2↑+4H2O(2分)
|