
题目列表(包括答案和解析)
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。 已知:
| 化学键 | N≡N | H—O | N—H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mo1/L) | 4.8 | 5.9 | 6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲ 、 ▲ ;
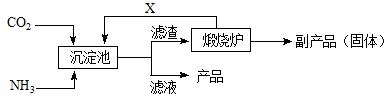
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲ 。
② 煅烧炉中产生的固态副产品为 ▲ ,生产流程中能被循环利用的物质X为 ▲ 。
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
| 化学键 | N≡N | H—O | N—H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mo1/L) | 4.8 | 5.9 | 6.0 |
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。 已知:
|
化学键 |
N≡N |
H—O |
N—H |
O=O |
|
键能/kJ·mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
|
生成NH3量/(10-6mo1/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲ 、 ▲ ;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
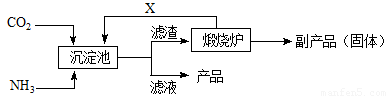
① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲ 。
② 煅烧炉中产生的固态副产品为 ▲ ,生产流程中能被循环利用的物质X为 ▲ 。
| 化学键 | N≡N | H—O | N—H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mo1/L) | 4.8 | 5.9 | 6.0 |
要表示如下:

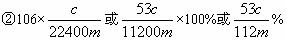
已知:沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O==NaHCO3↓+NH4Cl
(1)写出煅烧炉中发生反应的化学方程式__________________。
(2)该实验得到的纯碱中含有氯化钠。甲同学设计的测定样品纯碱含量的方法如图Ⅰ、图Ⅱ,试完成下列问题:
①写出烧瓶中发生反应的离子方式___________________________。
②该设计方案会造成误差,其原因可能为(写两种即可)______________________________、________________。
③若读取量筒中水的体积时俯视,由此会造成实验结果_______(填“偏高”“偏低”或“不影响”)。
(3)乙同学设计的测定样品中纯碱含量的方法如图Ⅱ,试完成下列问题:
①检查该装置气密性的方法为__________________。
②设滴定管的起始读数为a mL,终了读数为b mL,注射器测定排出的气体为c mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数表达式为__________________(用含a、b、c、m的代数式表示)。
一、二、选择题
题号
1
2
3
4
5
6
7
8
9
答案
A
B
D
C
B
C
A
D
C
题号
10
11
12
13
14
15
16
17
18
答案
AC
BD
BD
B
A
CD
D
BD
C
三、本题包括3小题,共33分
19.(10分)⑴CO2+NH3+NaCl+H2O=NaHCO3↓+ NH4Cl(2分)
⑵ ①稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收; (1分)
②烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收. (1分)
⑶①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后回到原来位置,说明气密性良好(1分)

(2分)
⑷①减少二氧化碳在水中的溶解,减小实验误差(1分)
②读数前将广口瓶与量筒之间导管中的水转入量筒;(1分)读取量筒中水的体积时要平视(1分)
20.(12分)⑴SO2 (g) + O2(g)
O2(g) SO3(g);△H ? 98.3 kJ/mol(2分)
⑵提高二氧化硫的转化率(2分)
⑶

 给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
⑷ 或 × 100%(2分)
⑸(3分)
 21.(共11分)
21.(共11分)
I.⑴ 2Cu(NO3)2 2CuO+4NO2↑+O2↑(2分)
 ⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
Ⅱ.⑴ 4HNO3浓 4NO2↑+O2+2H2O(2分)
⑵不正确。(1分)带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。(1分)
Ⅲ.用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。(2分)
四.(本题包括3小题,共33分)
22.(共10分)
⑴ (1)A ⑵CD ⑶熟石灰(1分) 2CaSO4? H2O+3H2O===2CaSO4?2H2O(2分)
H2O+3H2O===2CaSO4?2H2O(2分)
⑷S=C=O(2分)
⑸ NH3+HCl===NH4Cl(2分)
23.(10分)
⑴HClO4>H2SO4>H2CO3(2分)
⑵N2H4+4OH--4e-=N2↑+4H2O(2分)
|