
题目列表(包括答案和解析)
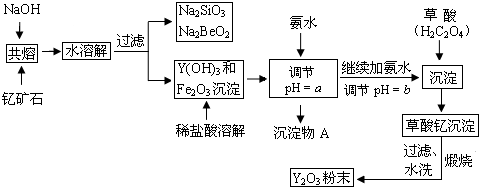
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
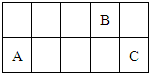 因周期表中过渡金属元素性质递变规律并不明显,可将其省略从而得到一张新的周期表.现有前三周期元素A、B、C,它们在该新周期表中的相对位置如图,下列说法正确的是( )
因周期表中过渡金属元素性质递变规律并不明显,可将其省略从而得到一张新的周期表.现有前三周期元素A、B、C,它们在该新周期表中的相对位置如图,下列说法正确的是( )| A、若A原子的最外层电子数比电子层数少1,则C的一种氧化物可以使品红溶液褪色 | B、若A的单质能与无水乙醇反应,则B的氧化物一定为酸性氧化物 | C、若A的氧化物为酸性氧化物,则B的最高价氧化物的水化物为强酸 | D、若A的氧化物可以与强酸、强碱反应,则氢化物的熔沸点C比B高 |
| A.若A原子的最外层电子数比电子层数少1,则C的一种氧化物可以使品红溶液褪色 |
| B.若A的单质能与无水乙醇反应,则B的氧化物一定为酸性氧化物 |
| C.若A的氧化物为酸性氧化物,则B的最高价氧化物的水化物为强酸 |
| D.若A的氧化物可以与强酸、强碱反应,则氢化物的熔沸点C比B高 |

元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
一、二、选择题
题号
1
2
3
4
5
6
7
8
9
答案
A
B
D
C
B
C
A
D
C
题号
10
11
12
13
14
15
16
17
18
答案
AC
BD
BD
B
A
CD
D
BD
C
三、本题包括3小题,共33分
19.(10分)⑴CO2+NH3+NaCl+H2O=NaHCO3↓+ NH4Cl(2分)
⑵ ①稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收; (1分)
②烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收. (1分)
⑶①关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后回到原来位置,说明气密性良好(1分)

(2分)
⑷①减少二氧化碳在水中的溶解,减小实验误差(1分)
②读数前将广口瓶与量筒之间导管中的水转入量筒;(1分)读取量筒中水的体积时要平视(1分)
20.(12分)⑴SO2 (g) + O2(g)
O2(g) SO3(g);△H ? 98.3 kJ/mol(2分)
⑵提高二氧化硫的转化率(2分)
⑶

 给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
给催化剂加热(1分) 因为该反应为放热反应,这样做是为了防止温度过高,而使SO2的转化率和催化剂的活性降低(2分)
⑷ 或 × 100%(2分)
⑸(3分)
 21.(共11分)
21.(共11分)
I.⑴ 2Cu(NO3)2 2CuO+4NO2↑+O2↑(2分)
 ⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
⑵正确,(1分)2Cu(NO3)2分解产生的混合气体中O2的体积分数与空气中O2的体积分数相当空气中带火星的木条不复燃,而在NO2和O2混合气体中木条复燃,所以NO2能支持燃烧。(2分)
Ⅱ.⑴ 4HNO3浓 4NO2↑+O2+2H2O(2分)
⑵不正确。(1分)带火星的木条熄灭可能是由于加热时产生大量水蒸气所致。(1分)
Ⅲ.用Cu与浓HNO3反应制取NO2气体,并用浓H2SO4干燥,再将带火星的木条伸入NO2中观察现象。(2分)
四.(本题包括3小题,共33分)
22.(共10分)
⑴ (1)A ⑵CD ⑶熟石灰(1分) 2CaSO4? H2O+3H2O===2CaSO4?2H2O(2分)
H2O+3H2O===2CaSO4?2H2O(2分)
⑷S=C=O(2分)
⑸ NH3+HCl===NH4Cl(2分)
23.(10分)
⑴HClO4>H2SO4>H2CO3(2分)
⑵N2H4+4OH--4e-=N2↑+4H2O(2分)
|