
题目列表(包括答案和解析)
| 阳离子 | Ba2+、H+、Na+、Mg2+ |
| 阴离子 | Cl-、SO42-、CO32-、OH- |
| 实验序号 | 实验内容 | 实验结论 |
| 1 | 用pH试纸测得A、C两溶液呈碱性,B、D两溶液呈酸性 | |
| 2 | A溶液与B溶液混合时,有无色气泡产生 | 化合物A为 Na2CO3 Na2CO3 (填化学式)B溶液中肯定大量含有H+ H+ (填离子符号); |
| 3 | C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解 | 化合物B为 HCl HCl ,化合物D为MgSO4 MgSO4 (填化学式). |
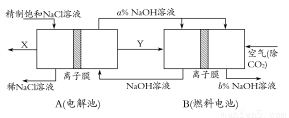
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
取化学式为MZ的黑色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内的黑色粉末状混合物中出现大量紫红色固体。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。根据以上叙述回答问题:
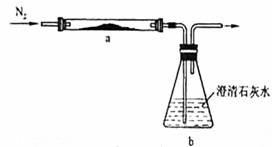
(1)元素Z的原子结构示意图是 ;
(2)请写出反应管a中可能发生的所有反应的化学方程式___________________,_________________,___________________,___________________;
(3)停止加热前是否需要先断开a和b的连接处?为什么? ;
(4)本实验的尾气含有CO需处理,请说明处理的方法。 。
1.A(碘单质遇淀粉变蓝色,而不是碘酸钾)
2.D(同温同压下,mg气体A与ng气体B的分子数目相同,说明物质的量相同,A、B、C正确,D同温同压下,气体A与气体B的密度之比等于它们的物质的量之比为m : n)
3.C(从③处导出的气体含有少量SO2、O2 、N2等,不可直接排入大气,否则造成污染)
4.A(B项由于不知道气体的状态,
5.A(放出热量ΔH<0,所以A错误;其它说法均正确)
6.A(水的热稳定性比较高是因为水分子中氢氧键的键能大;金属晶体导电是因为含有自由移动的电子;离子晶体硬度较大、难于压缩是因为离子键键能大)
7.D (D中上下移动时,两端液面始终平衡说明装置漏气)
8.B(过氧化钠固体与水反应,是放热反应,A、C错误;放热使广口瓶中气体温度升高膨胀,则右边升高左边下降)
9.A(ClO-+2I-+2H+===Cl-+I2+H2O;SO+I2+H2O===2I-+SO+2H+,所以可知氧化性为:ClO->I2>SO,因为②中加入过量的Na2SO3 溶液,所以③中含有BaSO3沉淀;①中硫酸只起到酸性作用,②只能证明SO有还原性)
10.C(二元弱酸应分步电离;草酸滴定KMnO4属于氧化还原滴定,不用指示剂;乙二酸脱水分解产物是CO、CO2和H2O)
11.A((NH4)2SO4和CH3COOH明显属于电解质;Cl2是单质既不属于电解质也不属于非电解质;虽然NH3的水溶液能够导电,那是由于生成了一水合氨的原因,故NH3属于非电解质。)
12.D(CsCl和NaCl的阴、阳离子排列方式不同;金属晶体中只有阳离子,没有阴离子;分子晶体中不一定含有共价键如稀有气体)
13.D(①说明有Br-、CO,有CO就没有Fe2+②说明没有SO③说明没有I-)
14.D(能发生这两个电极反应的可能是原电池,也可能是电解池,如果是原电池,则b为铁电极,a为没铁活泼的金属或非金属做电极,电解溶液为含铜离子的溶液;如果是电解池,b用铁做电极和电源的正极相连,a可以和铁相同的电极也可以不同,溶液为含铜离子的溶液)
15.C(A称量时应左物右码,B配制150mL0.10mol/L溶液应用150mL的容量瓶,而且要用玻璃棒引流;D冷凝水的方向应从下进上出)
16.D(①所取浓硫酸的体积少,②③④均造成溶质的损失)
17.问题1:(1)合成氨工业 硫酸工业(其他合理答案也正确) (2分)
问题2:Cu+4H++2NO(浓)===Cu2++2NO2↑+2H2O
3Cu+8H++2NO(稀)===3Cu2++2NO↑+4H2O(其他合理答案也正确)(2分)
化学?第页(见反面)问题3:放热 C(金刚石、s)=C(石墨、s);ΔH=-1.90kJ/mol(2分)
问题4:(1)第二个反应为:Al3++3OH-===Al(OH)3↓ (2分)
(2)最后一个离子反应为:Al(OH)3+OH-===AlO+2H2O (2分)
问题5:4KMnO4+5KI+7H2SO4===4MnSO4+I2+3KIO3+3K2SO4+7H2O (2分) (其他合理答案也正确)
18.(1)①2Cl--2e-=Cl2↑(2分) 用湿润的淀粉-KI试纸靠近Y极支管口(其它合理答案均可)(2分)
②由于2H++2e-=H2↑ 放出氢气,使水的电离平衡向正反应方向移动,使c(OH-)不断增大,所以pH会增大(2分)
③先有白色沉淀生成,继而变成灰绿色,最后变成红褐色(2分)
(2)①A(1分) ②B(1分)
19.(每空2分)(1)NaI NaClO
(2)2I-+ClO-+H2O===I2+Cl-+2OH- I2+5ClO-+2OH-===2IO+5Cl-+H2O
(3)Cl2+2NaOH===NaClO+NaCl+H2O
20.(1)KClO3 (1分) H????????H(1分)
(2)①关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段稳定的水柱,则证明I气密性良好。 (或用止水夹夹住c处,向分液漏斗中加水,打分液漏斗的活塞,若分液漏斗中的水不再下流,则证明I气密性良好。)(2分)
②MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
③S2-+Cl2===S↓+2 Cl-(2分)
化学?第页 ④II III(1分) 除去氯气中的水蒸气(或干燥氯气)(1分)
(3)Cl2+H2O2===2HCl+O2(2分)
21.(1)7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L (每个2分)
解析:解答此题的关键是第(1)问.可根据得失电子数相等确定生成物NaCl、NaClO、NaClO3的物质的量之比,进而确定化学方程式中化学计算数.
(1)依题意可设生成NaClO的物质的量为4mol,NaClO3的物质的量为1mol,设生成NaCl的物质的量x,根据得失电子的物质的量相等,有:1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化学计量数之比与生成对应物质的物质的量相等,即等于9∶4∶1.据此可写出总的化学字方程式:7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com