
题目列表(包括答案和解析)
甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。 w_w w. k#s5_u.c o*m
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳: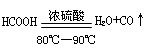 ,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。

①从下图挑选所需的容器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、
胶皮管,固定装置不用画)w_w*w.k*s 5*u.c*o m
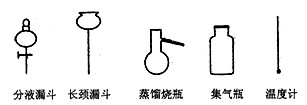
②装置Ⅱ的作用是______________________________________________。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸斥制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4NaHCO3==Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+5H2O==2Cu(HCOO)2·4H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
③步骤i是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是__________________________________________。w_w*w.k*s 5*u.c*o m
④步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70~80℃,如果看到_____________________(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是_______________________________。
⑥用乙醇洗涤晶体的目的是________________________________。
(10分)江苏省拥有丰富的海洋资源,盐化工是连云港市的主要产业之一。从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl。
![]() 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
 |
![]()
![]()
![]()
![]()
![]()
并设计出下面的实验流程:w.w.w.k.s.5.u.c.o.m
![]()

![]()
![]()
![]()
![]()
根据他们提供的数据和实验回答下列问题:
![]() 问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。

问题3:MgO则是重要的耐火材料。在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2?6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则 a∶b≈_______(取整数值)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com