
题目列表(包括答案和解析)
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表;
其中A、B两种原子的核电荷之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,且D和E的原子序数之和为30.
(1)D和E同属哪一周期元素?推断依据是什么?
(2)根据题目提供的条件,推断正在周期表中的族序数所必需的条件是什么?
(3)向甲的水溶液中加入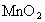 ,反应的化学方程式为:
,反应的化学方程式为:
(4)已知乙的相对分子质量大于甲.在实验室里常用什么反应原理来制得乙?
(5)向3mL1mol/LKI溶液中依次注入下列试剂:①1mL5mol/L盐酸;②0.5mL30%甲溶液;③1mL丁,经充分振荡后,静置,可得——紫色溶液.这种紫色溶液是____________.
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表;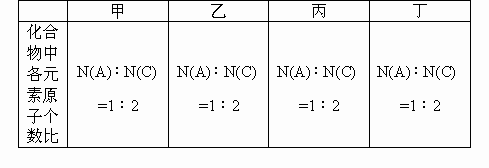
其中A、B两种原子的核电荷之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,且D和E的原子序数之和为30.
(1)D和E同属哪一周期元素?推断依据是什么?
(2)根据题目提供的条件,推断正在周期表中的族序数所必需的条件是什么?
(3)向甲的水溶液中加入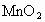 ,反应的化学方程式为:
,反应的化学方程式为:
(4)已知乙的相对分子质量大于甲.在实验室里常用什么反应原理来制得乙?
(5)向3mL1mol/LKI溶液中依次注入下列试剂:①1mL5mol/L盐酸;②0.5mL30%甲溶液;③1mL丁,经充分振荡后,静置,可得——紫色溶液.这种紫色溶液是____________.
有五种原子序数在36以内的元素A、B、C、D、E,它们的原子序数依次增大,A原子的最外层电子数等于其电子层数,A、B、C原子核外电子层数之和是6,C原子的电子数为A和B两元素原子电子总数的两倍;D和C的最高价氧化物对应水化物的酸性前者强于后者;E可和C形成原子个数比为1:1和1:2的两种化合物,其中一种物质是工业合成硫酸的常见原料,这两种化合物的摩尔质量相差32。试回答下列问题:
(1)E在周期表中的位置是 ,基态B原子的价电子排布式 。
(2)写出CD2的电子式 ,根据价层电子对互斥(VSEPR)理论推测,CD2分子的空间构型为 ,该分子是 分子(填“极性”或“非极性”)。
(3)通常情况下,AB3为无色有刺激性气味的液体,沸点303.8K,熔点193K。AB3固态时的晶体类型为 ;其水溶液有弱酸性,它的电离方程式为 。
(4)下列性质可作为比较C、D两元素非金属性强弱依据的是 (填编号)。
①C、D的最高价氧化物对应水化物的酸性强弱
②C、D的气态氢化物的水溶液的酸性强弱
③C、D的气态氢化物的稳定性强弱
④C、D的简单离子是否易被E3+氧化
⑤相同条件下,C、D的钠盐溶液的碱性强弱
(1)R原子的摩尔质量为__________;R在周期表中第周__________期第__________族。?
(2)假若把少量的R4+加到FeCl2溶液中是否发生反应?若不反应,说明理由;若反应,写出其离子方程式______________________________________________________________。
(3)R3O4被大量用于油漆涂料,涂在钢铁表面有利于形成耐腐蚀的钝化层。R3O4与足量的硝酸反应,生成R的氧化物,R的硝酸盐和水三种物质,此反应的化学方程式为__________________________________________________________________。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com